김정훈 교수(의과학과)
유전자교정 기술은 1세대 유전자가위인 zinc-finger nuclease, 2세대 transcription activator-like effector nuclease, 3세대 clustered regularly interspaced short palindromic repeat (CRISPR) 순으로 개발되었는데, 특히 CRISPR 유전자가위의 경우 이전 유전자가위에 비해 개발이 용이하여 실용화를 위한 연구가 활발히 진행되고 있다. 유전자가위를 질병 치료에 이용할 때 몸 밖으로 세포를 꺼내 교정한 후 다시 주입하는 방식인 ex vivo (생체밖) 치료를 시행하는 것이 더 많이 시도되고 있기는 하지만, 유전성 질환 및 비유전성 질환의 치료를 위해서 유전자가위를 몸 속으로 주입하여 목표 기관에 도달시켜 유전자교정 효과를 얻는 in vivo (생체내) 치료를 활용할 수도 있다. 본 연구진은 망막질환의 치료에 있어 안구내 주사를 통해 유전자교정 기술의 치료 효과를 확인하는 첫 논문을 2017년 발표한 이후 관련한 중개연구를 지속하고 있다. (Nat Commun. 2017 Feb 21;8:14500, Genome Res. 2017 Mar;27(3):419-426)
이번 연구는 IBS 김진수 단장 연구팀과 협력 연구를 통하여 진행한 성과로 Lachnospiraceae bacterium ND2006에서 추출한 핵속핵산분해효소(endonuclease)인 LbCPf1을 기반으로 연령관련황반변성(age-related macular degeneration)의 병리과정에 관여하는 Vegfa 및 Hif1a 유전자의 억제를 유도하였다. 유전자가위의 효율은 목표 유전자의 해당 부위에서 일부 염기서열의 삽입 및 결손(insertion and deletion, indel)이 일어난 정도로 표시하는데, 유리체강 내로 Vegfa 및 Hif1a 유전자를 목표로 LbCpf1을 인코딩하는 아데노연관바이러스를 주사하였을 때 유효한 indel 효율을 확인할 수 있었다(그림 1).
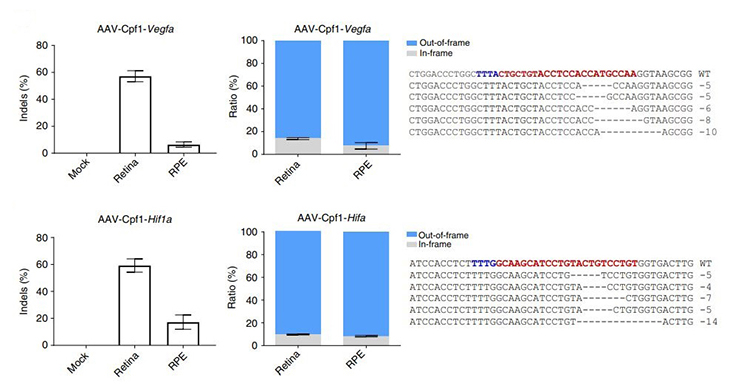
그림 1. 망막(Retina) 및 망막색소상피(RPE) 조직에서 목표 유전자(Vegfa 및 Hif1a) 내 염기서열 삽입 및 결손(indel) 비율
특정 염기서열을 목표로 하는 유전자교정 기술의 특성 탓에 원하지 않는 유전자에 작용하는 소위 off-target 효과에 대한 우려가 있다. 목표 유전자의 해당 염기서열과 유사한 유전자 부위를 발굴하는 Digenome-seq이나 Cas-OFFinder를 통해 off-target 부위를 확인하였지만, 실제 망막 및 망막색소상피 조직에서 유의한 off-target 효과는 없었다(그림 2).
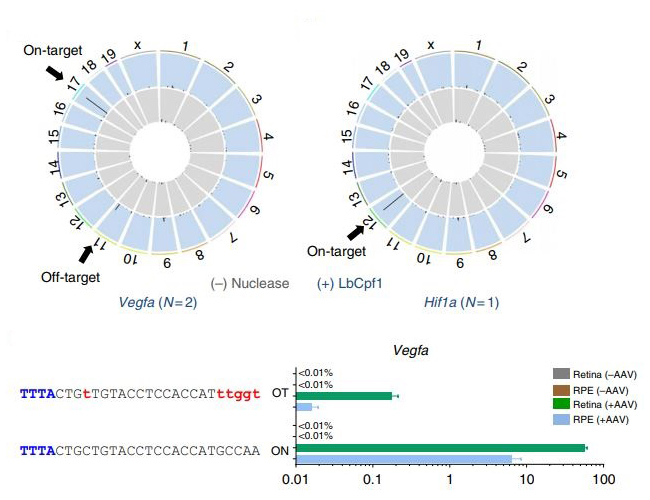
그림 2. 실제 망막(Retina) 및 망막색소상피(RPE) 조직에서 on-target 및 off-target 부위에서 indel 효율
이와 같이 높은 효율성과 특이성을 바탕으로 습성 연령관련황반변성 생쥐 동물모델에서 Vegfa 및 Hif1a 유전자의 억제를 통해 치료효과를 확인하였다. LbCpf1을 망막 및 망막색소상피 조직에서 발현할 수 있는 아데노연관바이러스를 유리체강 내로 주사하였을 때, 맥락막 신생혈관의 형성이 유의하게 감소하는 것을 확인하였다(그림 3). 본 연구진이 이전 연구에서 보고한 바와 같이, 리보핵산단백질 형태 또는 아데노연관바이러스 내에 탑재한 형태의 유전자가위를 통해 망막질환을 포함한 여러 질환의 생체내 치료를 시행할 수 있을 것으로 기대된다.
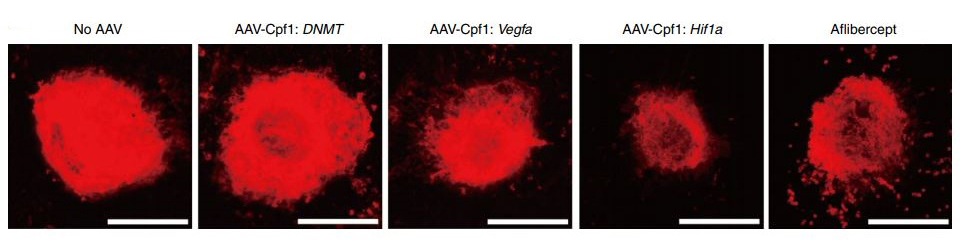
그림 3. LbCpf1 유전자가위를 통한 맥락막 신생혈관 형성 억제 효과
원문보기 : https://www.nature.com/articles/s41467-018-04175-y