[연구동향]
Compression–Assisted Lymphoscintigraphy for Quantitative Evaluation of Breast Cancer–Related Lymphedema
CLINICAL NUCLEAR MEDICINE, 2023

(재활의학교실,공동교신저자)

(서울대학교병원
핵의학과,공동교신저자)
이번 연구는 서울의대 재활의학교실 연구팀과 핵의학교실 연구팀이 같이 수행한 연구로 유방암 수술 후 발생하는 림프부종의 상태를 평가하고 나타나는 소견이 림프부종 치료 효과를 예측할 수 있는지를 기존 림프신티그래피와 비교한 연구이다.
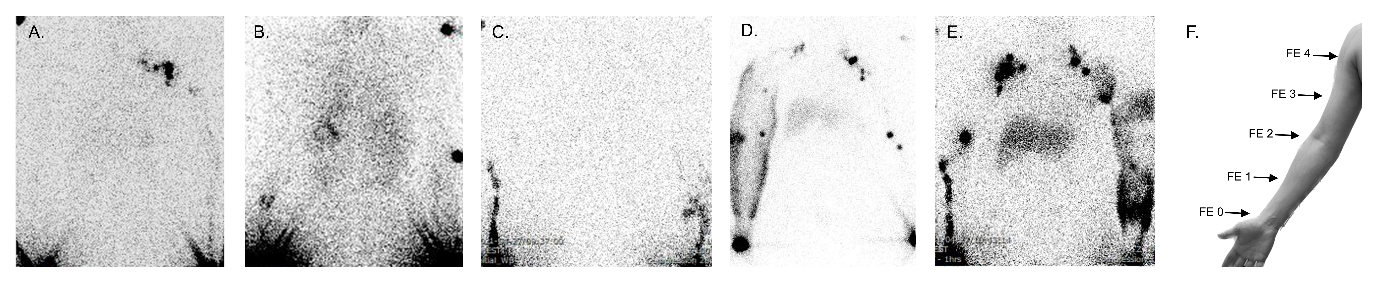
림프부종은 유방암 수술 및 방사선 치료에 의한 림프조직의 손실로 상지에 림프액이 저류되며 나타나는 질환이다. 아직 림프조직의 재생이 어려워 림프부종이 발생하면 완치는 어렵고 신체적, 정신적, 기능적인 문제를 일으킨다. 림프부종 환자의 손상된 림프계를 영상으로 분석하는 방법은 CT, MRI, 초음파 등이 있다. 이러한 영상 방법은 상지에서 부종이 있음을 영상으로 알 수는 있지만 원인인 림프계의 손상과 현재 상태를 알기는 어렵다.
아직까지 림프부종에서 영상으로 전체 림프계의 상태를 파악할 수 있는 것은 림프신티그래피가 유일하다. 소량의 방사선 동위원소를 원위부 피하조직으로 주사하여 림프계로 흡수시키고 반복적인 손의 운동으로 동위원소를 근위부와 체간까지 이동시켜 지연영상을 얻어 림프계의 손상과 남아있는 림프계를 파악한다. 하지만 이동시키는 방법이 환자의 자발적이고 반복적인 주먹쥐기에 의존하여 사람마다 이동하는 정도가 다르고 림프신티그래피의 신뢰도가 감소한다. 아직까지 림프신티그래피는 상태를 파악하는 데에 영상으로 볼 수 있는 것 외에 림프부종의 치료 효과 등을 예측하는 데에 한계가 있어 임상 치료의 근거로 사용하는데 한계가 있다.
본 연구진은 림프부종 치료로 사용하는 공기 압박 기계를 방사성 동위원소의 이동에 사용하여 환자별로 차이를 줄이고자 하였으며 생리적 흐름을 유도하여 림프부종의 치료로 사용하는 복합물리치료 효과와 영상 소견을 비교하여 치료효과를 예측하는 데에 도움이 되는지 분석하였다. 기존의 영상법에 비해 공기 압박을 이용한 림프신티그래피에서 동위원소의 이동에 따라 상지의 부종 감소 효과가 일치하였고 특히 팔꿈치 위로 이동이 있을 때 부종 감소효과는 더 크게 나타났다. 따라서 새로운 영상 방법에서 동위원소가 더 근위부로 올라갈수록 림프부종 효과가 크고 이는 영상을 바탕으로 부종 치료를 하기 전에 효과를 예측할 수 있음을 증명하였다.
이번 연구는 영상 분석과 임상 치료 분야의 협업으로 구성되어 기존 영상의 한계를 임상 치료방법의 도입으로 보다 정교하게 얻을 수 있음을 보여준다. 난치성 질환의 극복에 영상을 바탕으로 객관적인 치료 선정과 예측을 할 수 있는 한 예이며 영상과 치료 방법의 합작을 통한 임상 현장에서 쉽게 도입할 수 있음을 입증하는 우수한 연구결과를 얻을 수 있었다.


High-glutathione mesenchymal stem cells isolated using the FreSHtracer probe enhance cartilage regeneration in a rabbit chondral defect model
Biomaterials Research, 2023

(정형외과학교실,교신저자)

(서울대학교병원 정형외과,
공동제1저자)

(협동과정 줄기세포생물학,
공동제1저자)
이번 연구는 서울의대 정형외과 연구팀과 ㈜ 셀투인과의 공동연구를 통해 고기능성 중간엽줄기세포의 분리배양 기술을 통한 우수한 연골 결손 치료 효능을 확인한 연구로, 배양 공정의 표준화 및 품질관리의 부재, 충분한 수의 세포를 확보하기 위해 장기간 계대 배양 시 줄기세포 성능 저하 등의 줄기세포 치료제의 제한점을 극복하기 위한 연구이다.
고기능성 줄기세포를 선택적으로 분리하기 위해 세포 내 대표적 항산화 인자인 글루타치온 (Glutathione; GSH) 레벨을 모니터링 할 수 있는 새로운 형광 표지자 (FreSHtracer probe)를 사용하여 세포 내 글루타치온 수치에 따라 중간엽줄기세포를 분리할 수 있었으며 이를 통해 고기능성 줄기세포 분리배양 기술을 확립했다.
줄기세포 특이적 마커 발현, 이동능, 콜로니 형성능 및 산화 스트레스 저항능을 통해 줄기세포능을 평가하고, 연골 분화 유도 시험을 통해 연골 분화 관련 인자들의 발현 및 3차원 배양을 통해 연골 분화능을 평가한 결과 GSH 수치가 높은 중간엽줄기세포에서 우수한 줄기세포능 및 연골분화능을 확인했다. 이어서 생체 내 연골 재생능을 평가하기 위해 토끼 연골 결손 모델을 사용하여 줄기세포를 관절내 주사하였고, GSH 수치가 높은 중간엽줄기세포만이 주변 조직과의 향상된 결합성 및 초자연골로의 재생을 보였다. 이 연구를 통해 다양한 나이의 공여자에게서 GSH 수치에 따른 고기능성 줄기세포의 선택적 분리 가능성을 제시하고, 높은 GSH 수치를 가지는 줄기세포 이식을 통해 우수한 초자연골 재생 가능성을 제시하는 연구이다. 더 나아가 연골 결손 세포 치료제 개발 공정의 품질관리 기준 및 표준화 확립 가능성을 제시하고, 줄기세포 배양 기술 개발에서 유효성과 안전성 평가를 위한 핵심 지표를 제시한 연구로 연골 결손 치료를 위한 줄기세포 치료제의 효과적 임상 적용에 한 발짝 더 나아가게 만든 연구로 생각된다.

논문링크 : https://biomaterialsres.biomedcentral.com/articles/10.1186/s40824-023-00398-3
Targeted degradation of α-synuclein aggregates in Parkinson’s disease using the AUTOTAC technology
Molecular Neurodegeneration, 2023

(의과학과,교신저자)

(의과학과,제1저자)
전 세계 노인 인구의 10% 이상이 퇴행성 뇌질환을 앓고 있다. 그중 파킨슨병은 전 세계 65세 이상 인구의 2~3%에 해당하는 1천만 명이 고통을 받고 있다. 초고령화 사회로 진입하면서 그 숫자는 기하급수적으로 증가하고 있으나 근원 치료제는 전무하다. 파킨슨병은 뇌속의 알파-시누클린(α-synuclein) 단백질이 응고되어 분해되지 않아 축적되면서 도파민성 신경세포가 손상 및 사멸되어 발생한다. 도파민 결핍은 운동 기능 및 인지 장애 등을 일으켜 궁극적으로 생체기능을 파괴한다. 현재 임상적으로 쓰이는 약물들은 도파민 생성을 조절하는 도파민 활성화 약제들로써 근원치료제가 아니라 대증요법이라고 할 수 있다. 따라서 파킨슨병의 근원치료제 개발을 위해서는 질병의 일차적 원인인 단백질 응고체를 환자의 뇌에서 표적분해할 수 있는 혁신적 신약개발이 절실하다.
권용태 교수 연구팀에서는 선행연구에서 오토파지 기반 단백질 표적분해기술을 개발해서 AUTOTAC (autophagy-targeting chimera) 이라 명명했다 (22’ Nature Commun. 13:904). AUTOTAC은 이중약물로 이루어서 1차 약물은 질병유발 물질에 결합하고, 2차 약물이 오토파지 조절인자인 p62에 결합하면, p62가 질병 단백질을 리소좀에 전달해서 분해시킨다. 본 기술을 이용하면 동일한 방식으로 대부분의 질병 관련 단백질을 표적분해할 수 있어 신약개발 플랫폼으로 이용할 수 있다.
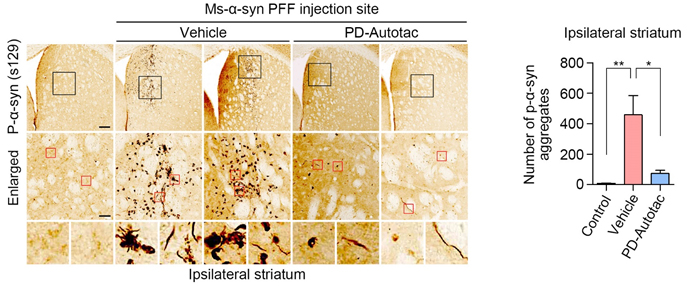
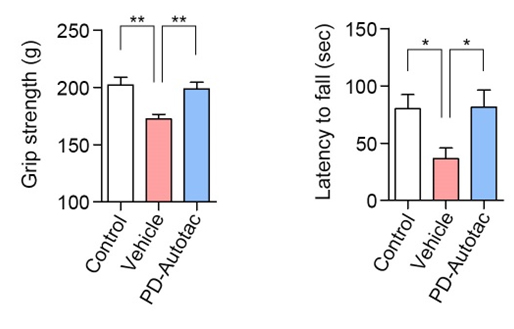
본 연구에서는 AUTOTAC 플랫폼을 이용해서 파킨슨병의 원인인 알파-시누클린 응고체를 특이적으로 인식해서 오토파지 경유 리소좀 매개 분해를 유도하는 키메라 저질량화합물 ATC161을 개발하였다. ATC161은 정상적으로 기능을 하는 알파-시누클린 단백질을 인식하지 않고, 병인 응고체만 특이적으로 인식해서 리소좀에 의한 분해를 유도하였다. 또한 병인 응고체에 의한 DNA 및 미토콘드리아 손상에 대한 강력한 치료 효과를 보였다. ATC161은 파킨슨 모델 쥐에 10 mg/kg의 dose로 경구 투여하였을 때 뇌에서 효과적으로 알파 시누클린 응고체를 분해하였다. 또한, 아교세포(glia)의 염증반응을 완화하였으며, 행동실험에서는 근력과 운동능력이 향상되었다. ATC161은 rat와 dog를 대상으로 하는 4주 반복 GLP 독성시험에서 NOAEL이 각각 240 및 500 mg/kg을 보이는 등 약물 안전성(safety)이 검정되어 2024년 1분기 임상1상이 계획 중이다.
이번 연구결과를 통해 최초로 파킨슨병을 직접적으로 일으키는 알파-시누클린 응고체를 제거할 수 있는 치료전략을 제시하였을뿐더러, 경구 투여 가능한 임상약물을 개발하였다. 또한, AUTOTAC이 파킨슨병 등 다양한 퇴행성뇌질환을 치료할 수 있는 플랫폼 치료전략이 될 수 있음을 증명함으로써 향후 임상적 의의가 클 것으로 기대된다.
논문링크 : https://molecularneurodegeneration.biomedcentral.com/articles/10.1186/s13024-023-00630-7

