[연구실소개]
폐암 발생 기전 및 치료 타겟 바이오마커 연구실(Lung Cancer Development and Therapeutic Biomarker Investigation)


< 정진행 교수(병리학교실) >
연구 주제 : 폐선암의 다단계 발생 모델에서 유전자 변이 규명과 치료 타겟 발굴 연구
저는 1998년 생쥐에서 폐암 발생 기전에 대한 연구로 박사학위를 받은 후 폐암 병리 연구에 일관되게 매진하여 왔습니다. 박사학위 실험은 생쥐에서 화학적 발암물질을 이용하여 폐암을 유발하고 1년 동안 관찰하면서 부검을 한 것이었는데, 생쥐의 폐 선암종이 다단계모델, 즉 adenoma-carcinoma 단계를 통하여 발생하며 각 단계별로 p53 종양억제유전자변이와 Rb 단백질 결손이 동반됨을 밝혔습니다. 저는 박사학위를 수행하면서 경험했던 생쥐 폐선암 모델처럼 사람의 폐선암도 다단계 과정을 거치며 이 과정에 유전자 변이가 있을 것, 또 다발성으로 발생하는 생쥐의 폐암처럼 사람에서도 다발성 폐선암종이 발생한다면 어떤 기전이 작용하는지 궁금하였고, 이런 환자들은 어떻게 진단하고 치료방침을 가져야 할지 병리학적 연구를 접목하고자 하였습니다.
저의 연구는 실제 환자에게 적용 가능한 것에 초점을 맞추어 왔습니다.
1) 조기 폐암환자들의 최소절제술을 유도하는 병리진단법 개발,2) PET에서 나타나는 림프절 전이 시그널의 세포병리학적 분석을 통해 위양성 결과를 예측함으로써 폐암 환자의 정확한 병기 예측에 도움을 주는 것,
3) 표적치료제가 중요한 폐암에서 바이오마커 선별 방법 수립,
4) 면역항암제 치료 반응을 예측하는 병리학적 소견 발굴 및
5) 폐선암의 T 병기에 새로운 병리요소가 도입되어야 함을 증명
6) 디지털 병리와 인공지능을 활용한 폐암 진단 및 치료 예측모델 개발 등입니다.
저는 연구 결과가 논문에만 그치지 않고 실제 폐암환자를 진료함에 있어서 적용할 수 있도록 새로운 접근방법을 제시하였고 그 중 일부는 세계폐암학회에서 가이드라인으로 채택이 되었습니다. 위에 기술한 것 중 4가지의 연구 결과는 출판과 동시에 제 논문에 대한 소개를 하는 Editorial과 함께 게재되는 영예를 안았습니다. 이러한 결과 덕분에 저는 종양 질환의 주요한 변화가 있을 때 발간되는 종양 교과서 블루북인 WHO classification of thoracic tumours의 4판(2015년)과 5판 (2021년) 집필에 공저자로 참여할 기회를 가질 수 있었습니다.
그리고 2010년부터 세계폐암학회 pathology committee member로 선임되어 활동하고 있으며, 이 그룹을 통하여 폐암의 분류 및 update 등을 주도적으로 참여하고 있습니다. (https://www.iaslc.org/research-education/research-committees-projects/pathology-committee)

< 세계폐암학회 (International association for the study of lung cancer: IASLC) Pathology Committee 홈페이지 >
제 연구실에서 지난 20여년간 수행해오고 있는 연구를 소개해드리도록 하겠습니다.
1) 다발성 간유리 음영으로 나타나는 조기 폐암의 진단과 치료 방침 수립
동양인에 흔한 EGFR 유전자 변이 폐암은 폐의 말단부위인 폐포 세포에서 기원하므로 초기에는 폐포벽을 따라 자라나는 형태 즉, CT 영상에서 간유리음영 (ground-glass opacity:GGO)으로 나타납니다. 고해상도 CT의 도입 이전에는 이런 병변은 발견되지 않았으나, 영상의학의 거대한 발전에 힘입어 이런 병변이 자주 발견되었고, 병리 소견이 알려지지 않은 초기에 이런 병변의 치료 방침은 혼선이 많았습니다. 대부분의 폐결절은 양성 병변이 많고 특히 결핵 유병률이 높은 우리 나라에서는 더욱 진단을 내리기 어려웠습니다. 폐는 생검으로 인한 후유증이 적지 않기에 생검을 하지 않고 바로 진단과 치료를 할 수 있는 방법을 모색하였고, 저는 폐조직을 동결절편에서도 인체내에서와 마찬가지로 확장시킬 수 있는 방법을 고안하여 GGO 병변(조기 폐암과 작은 육아종 등)에 대한 진단과 치료를 수술장에서 바로 마칠 수 있도록 하였습니다.
이 방법은 2008년 Lung Cancer지에 발표하였고, 2010년에는 많은 증례를 모아 정확도가 100%에 이름을 세계폐암학회 공식학술지인 J Thorac Oncol에 발표하였습니다. 그 당시만 해도 GGO병변이 흔하지 않아서, 흥미롭지만 왜 이런 방법으로 동결절편까지 하는지 모르겠다는 미국 병리학자의 코멘트가 있었습니다. 그러나, 2013년 미국의 National Lung Cancer Screening Project이후 CT로 선별되는 조기 폐암의 경우 폐기능을 보존하는 최소절제술의 필요성이 대두되었습니다. 이는 병리학적 진단이 되어야 한다는 것을 전제로 합니다. 2018년 미국 뉴욕MSKCC에서는 2008년, 2010년 발표된 제 논문을 인용하면서 [one step 동결절편 진단-치료]의 유용성에 대하여 소개를 하는 논문을 발표하였습니다.
이는 저의 진단 방법이 미국보다 10여년 앞선 것을 증명하는 것으로서, 조기 폐암의 진단과 치료분야에 있어서 서울대병원의 성적이 우수한 하나의 이유가 될 것으로 자부합니다. 또한 3 mm가량의 미세한 폐의 전암성 병변을 신선한 상태로 확보하는 기술을 가짐으로써 폐암의 다단계 모델을 연구할 수 있는 희귀한 자원을 가진 독보적인 그룹으로 성장할 수 있었습니다. 이 방법을 활용하여 폐의 [adenomatous hyperplasia- carinoma in situ- invasive adenocarcinoma] sequence에서 일어나는 다양한 유전자 변이를 규명하였고, 다발성으로 일어나는 경우 유전체특성이 개개의 병변마다 다름을 밝혀 이는 전이가 아닌 독립적 다발성 종양으로 낮은 병기에 준하여 치료해야 함을 증명하였습니다.
2) 폐암의 ALK 유전자변이 선별법 개발 및 세계폐암학회 가이드라인 수립
폐암은 유전자 변이에 의한 발암기전이 알려졌고 최근에는 이를 표적으로 한 치료제 개발이 폐암 진료의 패러다임을 바꾸었습니다. 2007년 폐암의 새로운 표적물질인 ALK 유전자 fusion이 알려지고 Pfizer에서 crizotinib 신약이 개발되어 2010년부터 우리나라에서 다국적임상시험을 주관하게 되었습니다. 이 소식을 듣고 저는 신약 임상시험과 더불어 병리 진단법을 개발하고자 몰두하였습니다. 당시 전체 폐암환자의 5-7%에 해당하는 ALK 유전자 변이 폐암 환자를 진단하는 표준적 방법은 FISH였는데, 이는 비용이 많이 들고 암실에서 1000배의 형광현미경으로 일일이 시그널을 카운트해야 하는 노동집약적인 방법이라 시간도 많이 걸리며 에러가 있을 수 있다는 점이 단점이었습니다. 그럼에도 불구하고 폐에서는 ALK 단백질의 발현도가 낮기 때문에 단백질 검출을 통하여 진단하는 것은 사용할 수 없다는 것이 학계의 정설이었습니다. 저는 이 점을 극복하고자, immunohistochemistry의 방법 중 항원증폭단계를 30가지 이상으로 다양한 방법으로 변형하는 실험을 하였고, 마침내 ALK 유전자 fusion을 선별하는 방법을 개발하는데 성공하였습니다. 이 방법은 민감도 100%, 특이도 98%에 이르는 매우 정확하고 신속한 방법이었고, 당시 폐암학계에 큰 화두가 되었습니다. 이 연구 업적은 J Thorac Oncol 2011년에 게재되었으며, 현재까지 300회 이상 인용되어 JTO최우수인용 논문으로 선정되기도 하였습니다. 당시 Editorial에서는 저의 IHC 방법이 FISH 진단법을 대체하기는 어려울 것으로 예측하였으나, 현재 ALK 폐암환자들은 ALK 단백검출인 IHC 방법으로 확진받고 약제를 투여받고 있습니다. 이 연구 결과는 세계폐암학회에 초청강연을 수차례 받게 한 저의 대표적 논문이며, 세계폐암학회 교육프로그램, Meet to Expert (MTE) 세션에 연자로 설 수 있게 하였습니다. 또한 이 연구 결과는 다양한 국가의 수많은 후속 연구 논문들로 검증이 되었으며, 2013년 세계폐암학회에서 “Atlas of ALK testing” 이라는 책을 집필하게 되는 계기가 되었고 현재 2판까지 출판하였습니다. 이 책에서 제가 제안한 진단 알고리듬이 ALK 유전자 전위를 선별할 수 있는 진단법으로 소개되었습니다. 현재 ALK 변이 폐암 환자들은 더 이상 유전자 검사나 NGS를 하지 않고 면역조직화학검사 결과만으로 약제를 투여받을 수 있게 되었습니다.
이 결과는 서울대병원에서 수술한 폐암 환자 코호트만으로 도출된 것으로써, 세계폐암학회에서 선도적으로 중개연구를 이끌어 낸 것으로 자부합니다.
3) 폐암의 병기 결정 FDG-PET의 위양성, 위음성 결과의 세포수준의 최초 규명
2000년대 초반 국내에 도입된 지 얼마 되지 않은 PET는 암의 병기 결정에 도움이 되는 의료진단장비였으나, 위양성, 위음성 결과에 대하여 정확한 세포생물학적 수준의 이해가 부족한 현실이었습니다.
흉부집담회를 하면서, 수술 이전 시행한 PET에서 종격동 림프절 전이로 판정되어 수술이 불가할 것으로 여긴 폐암환자들이 수술 후 병리학적으로 전이되지 않은 것으로 진단되거나, 그 반대로 PET에서 음성이었으나 전이가 있는 것으로 판명된 증례를 경험하면서 그 원인을 분석하고자 하였습니다. 대사가 활발한 세포는 당흡수가 높고 이는 당흡수를 촉진하는 세포막 수용체(Glut1)와 연관된다는 점을 볼 때, 저는 반드시 악성종양이 아니더라도 염증이나 임신 등으로 인하여 대사율이 높은 세포는 당흡수가 높을 것으로 추측하였습니다. 이에 저는 PET 검사를 받고 수술한 폐암환자들의 검체에서 종격동 림프절을 골라 Glut1 발현을 면역조직화학검사법으로 평가하고, Glut1을 발현하는 세포 및 림프절의 염증상태를 scoring하고, 이 환자들의 PET 시그널 SUV값을 비교하였습니다. 매우 흥미롭게도 Squamous cell carcinoma의 경우 SUV 평균값이 매우 높고, 림프절 염증이 많았으며 Glut1 발현도 높았습니다. 염증이 있는 림프절에서도 Glut1 발현이 매우 높았는데, 이는 림프절에서 Glut1 발현을 규명한 첫 번째 논문입니다. 흡연자에서 호발하는 squamous cell carcinoma 환자들은 종격동림프절에도 염증이 높고, Glut1 섭취도 높으므로 이 환자들의 수술 전 PET에서 높게 나타나는 림프절 SUV 값은 염증으로 인한 위양성일 가능성이 높음을 증명하였습니다.
또한 Adenocarcinoma의 경우 mucin이 많은 세포의 특성상 Glut1 발현이 낮으므로 종양의 SUV값도 낮고 전이한 림프절에서도 시그널이 낮을 것이므로 위음성 결과가 높음을 제시하였습니다. 이 결과는 폐암분야 핵의학 PET의 실제 활용에서 문제가 되는 위양성, 위음성 결과의 원인을 세포생물학적 수준에서 밝힌 논문으로 평가되어 논문게재와 더불어 Editorial로 소개받았습니다.
이 논문의 revision 당시 A4 용지로 10장 분량으로 심사의견에 defense하면서 어려움을 겪었으나, 편집장과 주고받은 질문과 대답 내용을 그대로 Editorial로 싣는 걸 보면서 저는 학자로서 자기 연구 결과물에 대하여 어떤 자세로 임하여야 하는지 크게 배웠습니다. 이후에도 폐암의 PET 결과를 분석함에 있어서 다양한 요소, 즉 종양의 크기, 림프절의 크기 등을 고려해서 전이 여부를 결정해야 한다는 후속논문을 발표하여 이 분야의 발전에 기여하였다고 자부합니다.
4) 폐암의 전파 양식 최초의 전향적 병리 연구 결과 발표 및 T 병기 수정 제안
폐는 타장기와 달리 침윤깊이가 없는 특수성으로 인하여 T병기 결정에 어려움이 있습니다. 단순히 육안적으로 측정한 종양의 크기로만 T 병기가 결정되고 있습니다.
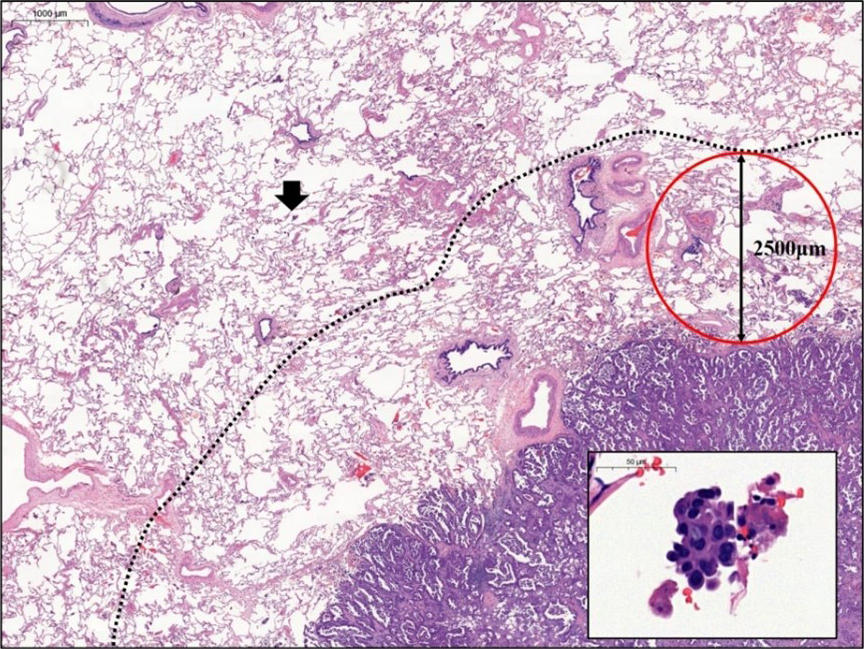
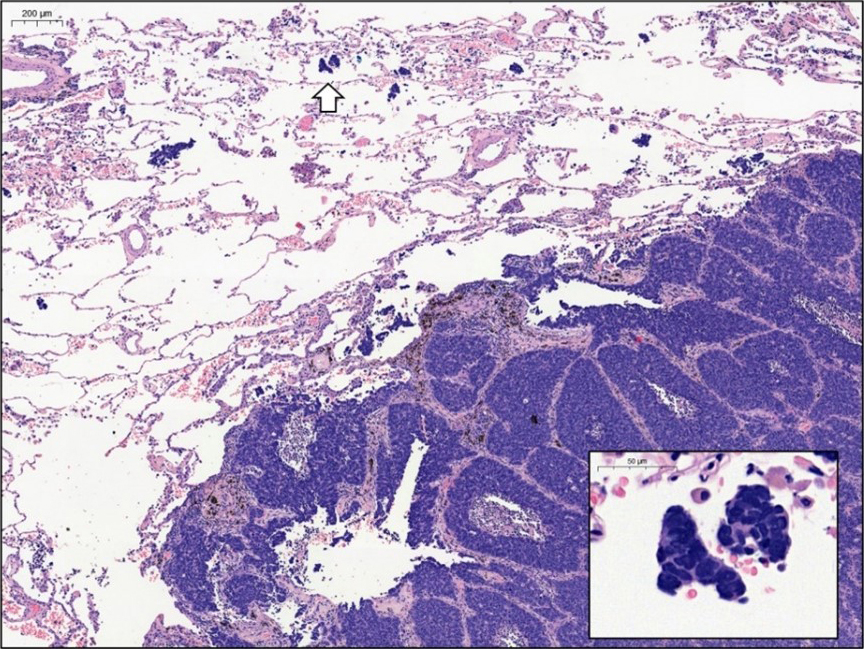
저는 폐암환자의 표본을 관찰하던 중, 현미경으로만 관찰되는 암세포의 공간 내 전파를 주시하여, 이를 2008년부터 병리진단지에 기록을 시작하였습니다. 그리고 이러한 현상이 폐암의 재발과 나쁜 예후인자로 유전자 변이 패턴과도 관련됨을 2013년에 논문으로 발표하였습니다. 2021년 그동안의 전향적 수집 데이터를 분석하여 T1 병기의 폐암에서 공간 내 종양세포 전파 (spread through air space: STAS)가 있을 때는 T2병기의 폐암보다 재발이 흔하며, 암사망율이 높음을 증명하는 논문을 미국병리학회지에 발표하였습니다. (Mod Pathol 2021) 그동안 후향적 연구로 STAS가 수술 후 재발 및 나쁜 예후 인자임은 소수의 환자를 대상으로 발표된 적은 있었지만, 전향적 데이터로 증명한 것은 처음이었습니다. 2019년 열린 세계폐병리학회 (Pulmonary Pathology Society)에서는 2008년부터 이 현상을 병리진단지에 기록한 최초의 병리의사로 소개되기도 하였습니다. NCCN guideline에 의하면, T2병기의 폐암환자는 수술 후 불량한 예후 인자가 있을 경우 보조적 항암치료를 권유하고 있습니다. 제 연구에서 T1 병기의 폐암환자일지라도 STAS가 있는 경우 T2와 마찬가지 예후를 보이므로, 수술 후 항암요법이 필요할 수도 있으며, 이런 환자들은 최소절제수술이 아닌 엽절제술 등의 표준적 광범위 수술법이 적용되어야 함을 제기하였습니다. 또 간유리음영으로 나타난 폐암에서 STAS가 있는 경우 최소절제술을 하면 9배 이상 재발률이 높음을 증명하는 논문을 발표하였습니다. 이는 병리학적 연구가 수술과 항암치료 등 폐암환자의 치료법을 변화시키는 것으로서, 서울대병원 폐암환자 코호트로 국제 표준인 T병기의 변화를 가져올 수 있는 기반을 마련하였다고 자부합니다. 또한 그동안 STAS가 표본 handling에 의한 artifact인지 실제 종양세포의 특성인지 첨예한 논쟁이 있었는데, 15년에 걸친 우리 병원 폐암환자의 전향적 데이터 수집을 통한 연구 결과로 STAS는 불량한 예후인자이며 artifact가 아님을 증명하여 논란을 종식시켰습니다. 그리고 세계폐암학회의 pathology committee 내에, STAS working group을 만들어 이에 대한 활동을 계속하고 있습니다. 이 논문은 발표 당시 전공의 3년차였던 한연비 선생의 박사학위 논문으로, 2020년 미국병리학회에 초록을 제출할 당시 우수 논문 수상후보로 선정되기도 하였고, 2019년 대한병리학회 및 2020년 대한폐암학회 최우수 구연상을 수상하기도 하였습니다. 전공의 기간중에 방대한 데이터를 정리하고 의미 있는 결론을 도출한 한연비 대학원생의 피땀어린 노력에 감사드립니다.
그동안 이와 같은 연구를 계속 할 수 있었던 것은 제가 서울대학교 의과대학에 재직하였기 때문입니다. 훌륭한 동료, 선후배와 더불어 배우고 모색하면서 더 나은 진료, 연구를 위하여 노력할 수 있었고, 우수한 학생들을 가르치고자 부족한 저 자신을 다그치며 공부할 수 있었던 것 역시 서울대학교 의과대학에 소속되어 있었기 때문입니다. 또한 서울대학교병원을 믿고 자신의 몸을 맡긴 환자분들이 계셨기 때문에 저의 연구가 가능하였습니다. 이러한 점을 잊지 않고 앞으로도 환자에게 도움이 될 수 있는 연구를 지속적으로 하고자 합니다. 감사합니다.
2. 연구실 구성원 소개 및 단체 사진
제 연구실 구성원들은 다음과 같습니다.
김효진 교수 :병리학전공/ 면역항암제예측 모델 개발이세준 교수: 컴퓨터 공학전공/ 디지털 병리/인공지능기반 MSI 검출 기법 연구
권현정 교수: 폐암의 진행모델에서 EMT 연구
한연비 박사: STAS 3D모델 구축 및 예후 연관성 규명
박사과정: 이정효, 권수현
학부생: 김성진 (학석사연계과정), 김창연, 이윤재 (본과 3학년)
박사졸업생:
이현주 (순천향의대 부교수)
유설봉 (전주예수병원 병리과 과장)
김효진 (분당서울대병원 부교수)
박은향 (연세대학교 병리학교실 조교수)
한연비 (분당서울대병원 임상강사)
Xu, Xianhua (중국 하이난암센터 과장)
Sun,Pingli (중국 길림대학 병리학교실 부교수)
Jin, Yan (중국 푸단대학 조교수)
김은선 : 행정 지원 및 데이터관리
공동연구자


