[연구동향]
Stereotypic neutralizing VH antibodies against SARS-CoV-2 spike protein receptor binding domain in patients with COVID-19 and healthy individual
Science Translational Medicine, 2021




항체는 중사슬과 경사슬로 이루어져 있고, 중사슬과 경사슬에는 각각 가변영역과 불변영역이 존재합니다. 중사슬 가변영역과 경사슬 가변영역은 조합하여 항원과 결합하는 부위인 파라토프를 형성합니다. 중사슬 가변영역은 VH, D, J 유전자가, 경사슬 가변영역은 VL, J 유전자가 조합하여 형성합니다. 사람은 유전자 조합을 통하여 1 X 1012 개 이상의 다양한 항체를 만들 수 있습니다. 하지만 인체의 혈액에 존재하면서 감염원을 감시하는 미접촉 B 림프구의 수는 1 X 109개 정도로 제한되기 때문에, 인체는 특정시점에 항체 다양성의 일부만을 선택하여 보유할 수밖에 없습니다. 따라서 감염원과 만나는 시점에 존재하는 항체 다양성은 감염 질환 이환과 임상상에 중요한 영향을 미칠 수 있습니다.
서울대병원 감염내과 오명돈 박완범 교수, 의대 생화학교실 정준호 교수, 공대 권성훈 교수 연구진은 COVID-19로부터 회복한 환자 17명 중에서 13명이 매우 유사한 중사슬을 보유하고 있고, 이 중사슬이 다양한 경사슬과 조합하여 SARS-CoV-2 바이러스의 세포 감염을 억제할 수 있음을 밝혔습니다. 흥미롭게도 SARS-CoV-2가 등장하기 이전에 수집된 정상인 혈액 샘플 10개 중 6개에서 이러한 중사슬이 발견되었습니다. 이 항체는 SARS 바이러스와 MERS 바이러스에는 결합하지 않아서, 이 항체의 존재가 COVID-19가 SARS나 MERS 대비하여 낮은 치명률을 보이고, 무증상 감염이 일어나는 원인 중 하나일 가능성이 있습니다. 이러한 항체가 어떻게 많은 사람들에게서 형성되는지, 이러한 항체를 보유한 사람은 바이러스 감염 이후 완화된 임상상을 나타내는지는 추가 연구를 통하여 밝힐 수 있을 것으로 기대됩니다.
Somatic uniparental disomy mitigates the most damaging EFL1 allele combination in Shwachman-Diamond syndrome
Blood, 2021



(소아과학교실)
(의과학과)
(의과학과 졸업,
현 UCSD 연구원)
Shwachman-Diamond syndrome (SDS)는 골수, 골격계, 췌장 등의 발달에 문제가 생기는 희귀질환으로서 SBDS라는 유전자의 돌연변이가 원인인 것으로 알려져 있다. 본 연구는 SDS가 강력하게 의심되었으나 SBDS 유전자에는 이상이 없던 환자를 진단하기 위해서 시작되었다.
본 연구진은 유전적 원인을 찾을 수 없던 SDS 환자 세 명과 부모들에 대한 엑솜 전장 유전체 분석을 진행하였다. 그 결과 세 환자 모두 공통적으로 EFL1이라는 유전자에서 compound heterozygous 변이(건강한 부모에게서 하나씩의 병원성 변이를 받아 환자의 두 대립형질이 모두 기능을 못하는 형태의 변이)들이 관찰되었다. 이 과정에서 특이한 점은 환자들의 혈액 유래 DNA에서 관찰된 EFL1 변이를 가지는 세포의 비율이 일반적인 변이와는 다르게 상당히 낮게 존재하고 있었다는 것이다. 그 이유가 모종의 체세포 특이적 재조합 현상 때문일 것이라는 가설 하에 실험을 진행하였고 그 결과 EFL1 상의 병원성 변이들 때문에 골수 세포의 생존율이 현저하게 떨어지게 되고, 이를 보상하기 위한 재조합 현상의 결과로 발생한 복귀주(revertant) 세포들이 원래의 골수 세포에 비해 더 많이 살아남아 있다는 것을 발견하였다. 하지만 이렇게 선택적으로 살아남은 복귀주 세포도 이미 그 기능이 현저히 떨어진 상태였고, 이로 인하여 SDS 질환을 발생시킨다는 것을 세포 실험과 물고기, 생쥐 모델을 통하여 증명하였다. 또한 EFL1도 SDS 질환의 주요 원인 단백질인 SBDS와 함께 세포 내 단백질 합성을 위한 80S 리보좀 합성 과정에 핵심적인 단백질임을 증명하였다.
본 연구를 통해 기존의 germline 변이 모델에서 한단계 진보된 체세포 내 변이 진화 모델을 실제 증명할 수 있었고 차세대시퀀싱 분석법의 도래 이후 약 50%에서 머물고 있는 희귀질환 환자 진단율을 향상시킬 수 있는 새로운 유전적 기작의 가능성을 증명할 수 있게 되었다. 특히 혈액 질환 환자의 경우 기존의 전통적인 시퀀싱 분석 방법으로는 변이를 발견할 수 없다는 것을 실제로 보여준 예로서 보다 민감도가 높은 시퀀싱 및 분석 방법이 필요함을 시사한다. 또한 SDS의 유전적 및 세포생물학적 발병 기작에 대한 이해 증대를 바탕으로 향후 산전 진단 등의 예방 및 새로운 치료 방법 개발의 토대 구축에 기여하였다.
또한 본 연구는 임상의사가 환자를 보며 임상양상으로 SDS 진단이 강력하게 의심되었으나 알려진 유전자 변이가 없어서 정확한 진단을 하지 못했던 환자에 대한 질문에서 시작된 연구로 기초연구자와 협동 연구를 통해서 답을 찾고 새로운 질병의 기전을 찾은 bedside-to-bench 중개의학 연구의 표본이라 할 수 있다.
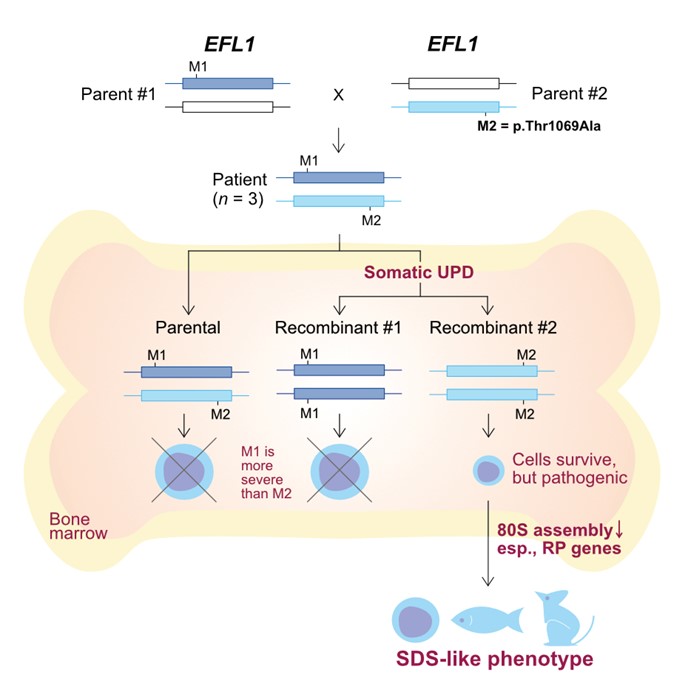
< 그림. SDS 환자와 부모가 지닌 EFL1 유전자의 변이들과 환자 골수 세포 내에서 일어나는 체세포 재조합 과정을 통한 복귀주(Recombinant #2 위치) 세포의 생성 과정. 이 세포들에서도 EFL1 변이(M2/M2)에 의하여 생존율이 떨어져서 결국은 SDS 증상을 일으킨다는 것을 증명함 >
논문링크 : https://ashpublications.org/blood/article-abstract/doi/10.1182/blood.2021010913
Low-Frequency Repetitive Transcranial Magnetic Stimulation Over Contralesional Motor Cortex for Motor Recovery in Subacute Ischemic Stroke: A Randomized Sham-Controlled Trial
Neurorehabil Neural Repair, 2020



(재활의학교실)
(분당서울대병원 재활의학과)
(서울대학교병원 재활의학과)
뇌졸중 후 신경세포의 손상으로 발생하는 팔과 손의 마비는 일상생활 동작에 어려움을 유발하고 삶의 질을 저하하는 중요한 장애 중 하나이다. 손상된 신경세포 자체는 회복되지 않지만 주위의 뇌 활성도가 회복에 도움이 되는 방향으로 재 조직화되는 신경가소성 (neuroplasticity)을 이용해 기능 회복을 극대화하는 것이 뇌신경재활 연구의 중요한 주제 중 하나이다. 분당서울대병원 뇌신경재활 연구팀은 뇌에 직접적인 자극을 줄 수 있는 반복적 경두개 자기자극 (repetitive transcranial magnetic stimulation, rTMS) 및 경두개 전기자극 (transcranial direct current stimulation, tDCS)을 이용해 뇌졸중 후 마비를 회복하기 위한 연구를 수행하고 있다. 연구팀에서 최근 수행한 아급성기 뇌졸중 환자 대상의 저주파 rTMS 적용 다기관 무작위배정대조군 임상시험에서는 뇌졸중 발생 부위에 따라 rTMS의 운동기능 회복 효과가 다를 수 있음을 확인하였다. 앞으로 본 연구팀은 rTMS 등 뇌자극술의 효과를 극대화하기 위해 MRI, 뇌파 등 기능적 뇌 영상 기술을 적용해 뇌졸중 환자의 특성에 따른 개별화된 자극 프로토콜을 개발하는 후속 연구를 지속할 예정이다.
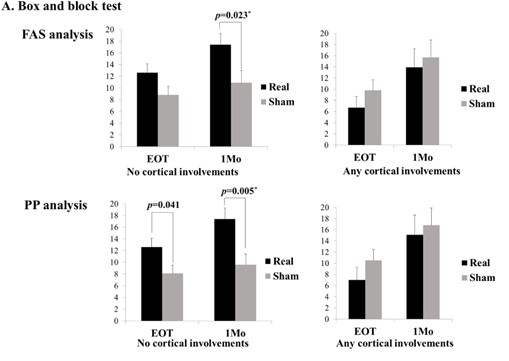
< 그림. 마비측 손의 기능이 진짜 rTMS (real)를 적용하였을 때 거짓 (sham) rTMS 적용과 비교해 더 회복하는 것을 뇌 피질을 침범하지 않은 경우 (no cortical involvements)에만 확인할 수 있음. >
Open versus laparoscopic surgery for mid or low rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): 10-year follow-up of an open-label, non-inferiority, randomised controlled trial
Lancet Gastroenterol Hepatol, 2021


(서울대학교병원 외과)
(외과학 교실)
직장암 수술은 한정된 좁은 골반 내에서 암 조직이 남지 않도록 하면서 자율신경과 괄약근 등 중요한 조직과 장기가 다치지 않게 수술해야 하기 때문에 기술적인 어려운 수술로 알려져 있다. 지금까지 한국, 유럽, 미국, 호주에서 시행한 직장암에 대한 복강경 수술 무작위 임상 시험들의 결과가 상충되어 직장암 복강경 수술에 대한 안정성에 대한 논란이 제기되어 왔었다. 2006년 4월부터 2009년 8월까지 서울대병원, 국립암센터, 분당서울대병원에서 수술 전 항암화학방사선 치료를 받은 2기 또는 3기 직장암 환자 340명을 복강경 수술군 170명, 개복 수술군 170명으로 무작위로 배정한 후 10년을 추적 관찰하였다. 2명의 환자가 추적 관찰이 중단이 되어 338명에 대한 생존율을 비교 분석하였다. 그 결과 복강경 수술이 개복 수술과 비슷한 생존율을 보였다 (그림 1). 이번 연구는 직장암에서 복강경 수술에 대한 논란을 종지부 찍고 복강경 직장 수술이 표준 수술법으로 자리 잡는데 중요한 근거를 마련하는데 기여하게 되었다.
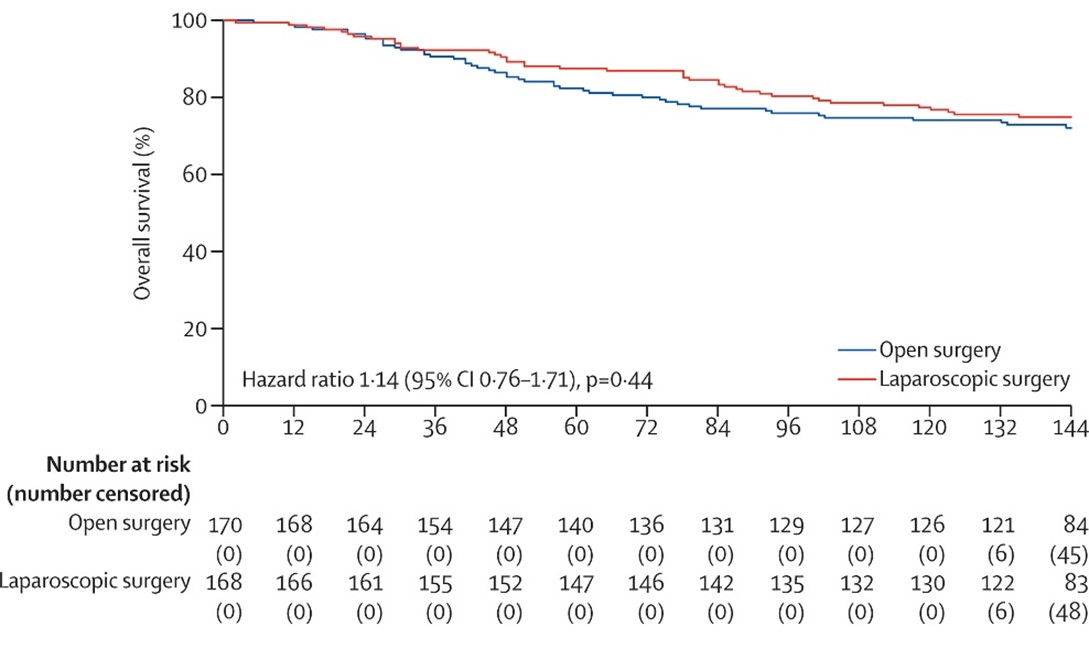
< 그림. 직장암 환자에서 복강경 수술 그룹과 개복 수술 그룹의 전체 생존율 >
논문링크 : https://www.thelancet.com/journals/langas/article/PIIS2468-1253(21)00094-7/fulltext

