[연구동향]
Sevabertinib in advanced HER2-mutant non–small-cell lung cancer
New England Journal of Medicine

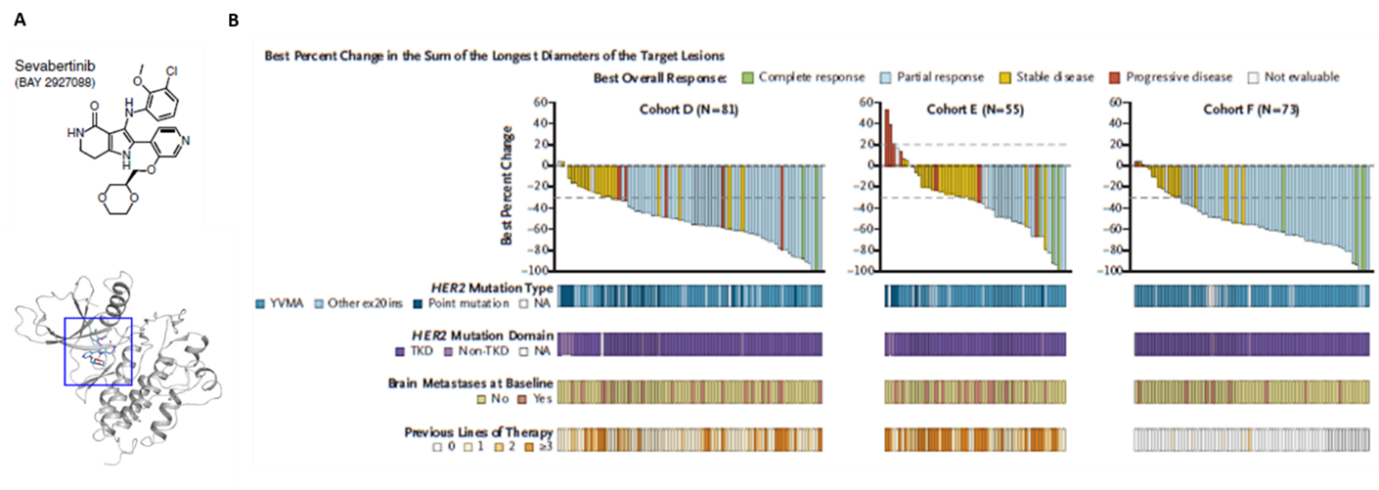
이번 연구는 미국 엠디엔더슨 암센터의 Xiuning Le 교수와 서울대학교병원/서울대학교 의과대학 내과학교실 김태민 교수가 공동제1저자로 HER2-돌연변이 비소세포폐암에서 경구 Sevabertinib의 역할을 규명한 다기관 글로벌 1/2상 임상시험 연구이다. HER2-돌연변이는 비소세포폐암의 2~4%에서 관찰되나 전이성 질환에서 치료 선택이 제한적이어서 본 임상시험이 디자인되었다. 1상 용량-증가단계에서 Sevabertinib 20 mg 하루 2회가 2상 권장확장용량으로 결정되었으며, 1차 표준항암화학요법에 실패한 HER2-돌연변이 진행성 비소세포폐암 환자 중 이전에 HER2-표적치료를 받지 않은 코호트 D (81명)와 이전에 HER2-항체약물접합체 치료를 받은 코호트 E (55명), 그리고 이전에 치료받지 않은 코호트 F (73명)가 이번 연구 결과에 포함되었다. 코호트 D에서의 반응률이 64%, 코호트 E에서의 반응률이 38%, 코호트 F에서의 반응률이 71%, 정중 반응기간이 11.0개월로 관찰되었으며 3등급 이상의 부작용이 31%에서 관찰되었다. 비교적 안정적이면서 좋은 효능을 보여 미국식품의약국에서 2025년 11월 19일 1차 표준항암화학요법에 실패한 HER2-돌연변이 진행성 비소세포폐암 환자에서 사용을 허가하였다.
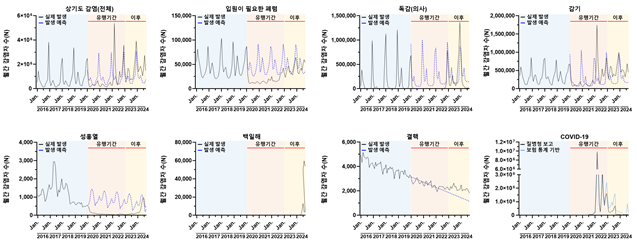
Incidence of respiratory infections after the COVID-19 pandemic (2023–2024) and its association of vaccination among entire populations in Korea
International Journal of Infectious Diseases

의과학과/가정의학교실 박상민 교수 연구팀은 국민건강보험공단과 질병관리청의 K-CoV-N 빅데이터를 활용해 전 국민 5,200만 명을 대상으로 코로나19 전후(2020~2024) 호흡기 감염병 발생 변화를 분석했다. 2017~2019년 자료를 바탕으로 SARIMAX 예측모형을 구축해 실제 발생률과 비교한 결과, 팬데믹 초기(2020~2021)에는 마스크 착용과 거리두기 등의 영향으로 독감 발생이 이전 대비 90% 이상 감소한 것으로 나타났다.
반면, 방역 완화 이후인 2023~2024년에는 감기와 상기도감염이 다시 증가했으며, 특히 감기는 예측 대비 2.2배, 백일해는 2023년 하반기 이후 예측 대비 약 46배 급증하는 등 뚜렷한 재유행 양상을 보였다. 이는 팬데믹 기간 동안 억제되었던 호흡기 감염병이 이후 급격히 반등한 현상을 보여준다.
또한 코로나19 백신 접종 횟수에 따른 분석에서는 폐렴·독감·백일해의 발생 위험은 감소하는 경향을 보인 반면, 감기와 상기도감염은 접종 횟수가 증가할수록 높아지는 양상이 관찰되었다. 이러한 변화된 호흡기 감염병 발생 양상과 백신과의 연관성은 코로나19 확진으로 인한 면역계 교란과 신체적 부담, 장기간 낮은 병원체 노출 이후 방역 완화로 인한 집단면역 공백, 그리고 독감-코로나19 백신 동시접종 등 건강행태 변화에 따른 간접적 효과를 시사한다.
Spatial Transcriptomic Analysis Reveals Increased Adipogenesis and Triggering of the Non-Alcoholic Fatty Liver Disease Pathway in Pig-to-NHP Islet Recipients' livers During the Early Post-xenotransplant Period
Xenotransplantation

(미생물학교실, 공동교신저자)

(미생물학교실, 공동교신저자)

(의과학과, 공동제1저자)
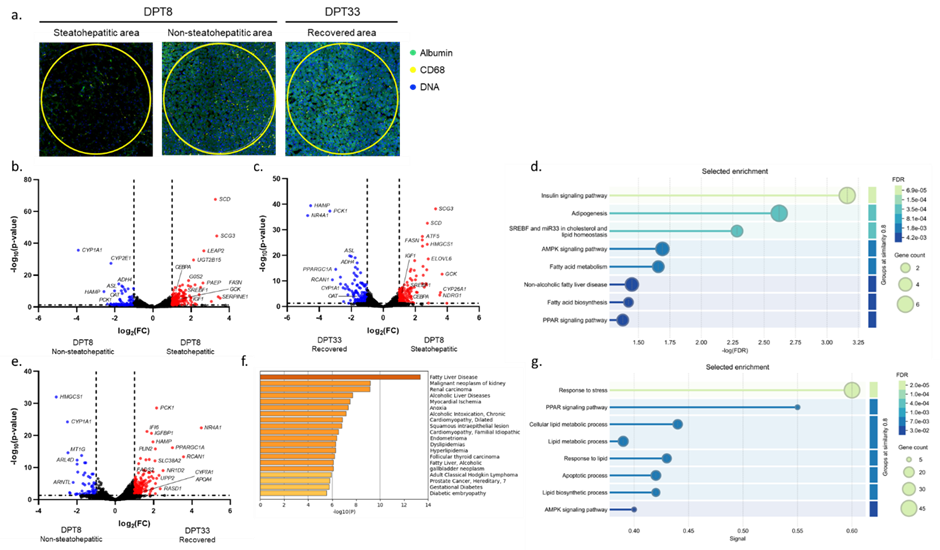
췌도 이식은 1형 당뇨병 환자에게 매우 유망한 치료법으로 간주된다. 그러나 장기 기증자 부족으로 돼지의 췌도를 이식하는 이종이식이 이 질환에 대한 대체 치료로 부상하고 있고, 유전자 변형 돼지의 개발로 미국과 중국을 중심으로 임상 시험이 시도되고 있다. 현재 췌도 이식은 사람을 포함한 대동물에서는 간을 주된 이식 부위로 사용하고 있다. 하지만 이식 후 간에서 발생하는 병리적 변화에 대해서는 아직 명확히 이해되지 못한 부분이 많다.
본 연구진은 이식 후 영장류의 간 병리를 조사했다. 특히 이식 부위 주변의 미세 환경을 정밀하게 분석하기 위해 공간 전사체(spatial transcriptomics) 분석법을 활용했다. 분석 결과, 이식 후 간 조직은 조직학적 구조와 일치하는 세 가지의 뚜렷하게 구별되는 전사체 영역으로 나눌 수 있었다. 이식 후 8일 시점에서 지방생성(adipogenesis)과 비알코올성 지방간 질환(NAFLD) 경로가 현저히 증가해 있었고, 이러한 경로는 SREBF1, IGF1, CEBPA, FASN, GCK, 그리고 SCD와 같은 유전자들의 발현 증가를 통해 확인되었다.
이식 후 33일 시점에서 육안으로 관찰했을 때는 간 병변의 심각도가 감소했음에도 불구하고, 전사체 수준에서는 여전히 지방간 질환의 명확한 증거가 남아있었다. 이러한 결과는 간 내 췌도 이식 자체가 간의 미세 환경에 상당한 영향을 미치며, 특히 지방 대사 및 NAFLD와 관련된 변화를 유도할 수 있음을 시사한다.
이 연구는 공동교신저자(김현제 교수)가 전일제 대학원생 시절이었던 2015년도에 시작되었다. 돼지 췌도 영장류 이식 후에 조직검사를 통해 간 실질의 변화가 관찰되었고, 이러한 변화가 일어나는 원인이 궁금해 당시 지도교수님이셨던 박정규 교수님(본 논문의 공동교신저자)께서, 지금은 은퇴하신 소화기 내과 이효석 교수님께 자문을 구하였다. 이효석 교수님은 국소적인 insulinemia로 인한 변화인 것 같다는 말씀을 주셨으나, 당시의 연구 기술로는 생각하시는 바를 정확히 증명할 수는 없었다. 마무리되지 못한 프로젝트는 졸업 후, 포스닥을 다녀오고 공간 전사체 연구 기술을 익혀 한국으로 와서 박정규 교수님 실험실에서 연구교수로 근무하던 시절인 2021년 당시 박사과정 학생이었던 방윤지 학생을 설득하여 결국 2025년에 출판할 수 있게 되었다. 임팩트 팩터가 높은 학술지에 연구가 실린 것도 뜻깊지만, 그보다 더 의미 있게 생각하는 것은 교수가 된 후 다시 지도교수님을 모시고, 10년 전 학생 시절에는 끝내지 못했던 연구를 훌륭한 학생들과 함께 마무리할 수 있었다는 점이다.
Long-term health and cost outcomes of a 24-week multicomponent frailty intervention in older adults
JAMA Network Open

예방의학교실 손호준 교수, 성균관대학교 장일영 교수, 지성환 박사과정생 및 서울아산병원, 평창군보건의료원 등 공동연구팀은 24주간의 운동·영양·정신건강·약물조정·주거환경 개선을 결합한 ‘노쇠 복합중재 프로그램’의 장기 효과를 입증하였다.
이 연구는 평창군 노인노쇠코호트(ASPRA)에 참여한 65세 이상 사회경제적 취약 노인 383명을 대상으로 24주간 복합중재 프로그램의 장기 효과를 시 ASPRA 코호트자료(187명은 중재군, 196명은 비교군)를 건강보험공단 자료와 결합하여 분석했다. 대상자들의 신체 건강 수준은 일반 노인보다 현저히 낮았다.
중재 프로그램은 주 2회 그룹운동과 단백질 보충음료 제공을 기본으로 하며, 필요시 우울 관리, 다약제 조정, 낙상 위험 환경 개선까지 포함한 지역사회 기반 통합 프로그램이며 1인당 총 872달러(약 99만원)이 소요됐다. 이후 60개월간 국민건강보험공단 자료를 추적 분석한 결과, 중재군은 비교군보다 사망 또는 장기요양 진입 시점이 평균 6.5개월 늦춰졌다. 1인당 의료비 누적 지출은 약 7,668달러(약 877만 원) 적게 나타나 중재법의 투자된 금액 대비 8배 수준의 편익이 발생하여 높은 경제성이 입증되었다. 이러한 경제적 효과는 초기 30개월 기간 중 외래 및 응급실 이용 감소로 병원 진료비의 감소, 장기적으로는 장기요양급여 이용 감소로 인한 효과로 확인되었다.
본 연구는 지역사회 기반 노쇠 예방 중재가 취약 노인의 건강수명 연장과 삶의 질 향상에 실질적으로 기여할 수 있음을 시사한다. 또한 의료비와 장기요양 비용 절감 효과를 통해 국가 차원의 효율적인 고령자 건강관리 정책 수립에도 중요한 근거로 활용될 수 있을 것으로 보인다.
Evaluation of familial phenotype deviation to measure the impact of de novo mutations in autism
Genome Medicine

이번 연구는 정신과학교실 유희정 교수 연구팀과 고려대학교 바이오시스템의과학부 안준용 교수 연구팀이 공동으로 수행했으며, 자폐의 유전적 기전을 가족 단위 분석을 통해 새롭게 규명한 연구이다. 연구팀은 부모와 형제자매의 임상적 특성을 함께 고려하는 방식으로, 기존 분석에서는 신호가 약해 포착되지 않던 유전적 기여를 보다 명확하게 드러낼 수 있는 새로운 접근을 적용했다.
그동안 자폐 연구는 부모에게는 없지만 자녀에게 새롭게 생긴 ‘새 발생 변이’를 중심으로 발전해 왔으나, 동일한 유전자 변이를 가진 자폐인들 간에도 증상의 정도가 크게 달라 변이 자체가 어떤 영향을 주는지 정확히 평가하기 어려운 문제가 있었다. 이러한 한계를 극복하기 위해 연구팀은 가족 내부의 임상적 차이를 비교 기준으로 삼아, 개개인의 절대 점수가 아닌 가족 안에서의 상대적 변화에 초점을 두었다. 이를 통해 기존 방식에서는 유의하지 않게 보였던 유전적 영향도 안정적으로 포착할 수 있도록 분석 정밀도를 높였다.
이 접근을 대규모 한국과 미국의 대규모 자폐 가족 코호트(21,735가구, 78,685명)에 적용한 결과, 지금까지 보고되지 않았던 신규 자폐 연관 유전자 18개를 발굴하는 중요한 성과를 얻었다. 이 유전자들은 단백질 변형 조절, 신호 전달, 뇌의 다양한 신경 보조 세포와 관련된 기능 등 새로운 생물학적 축을 제시하였다.
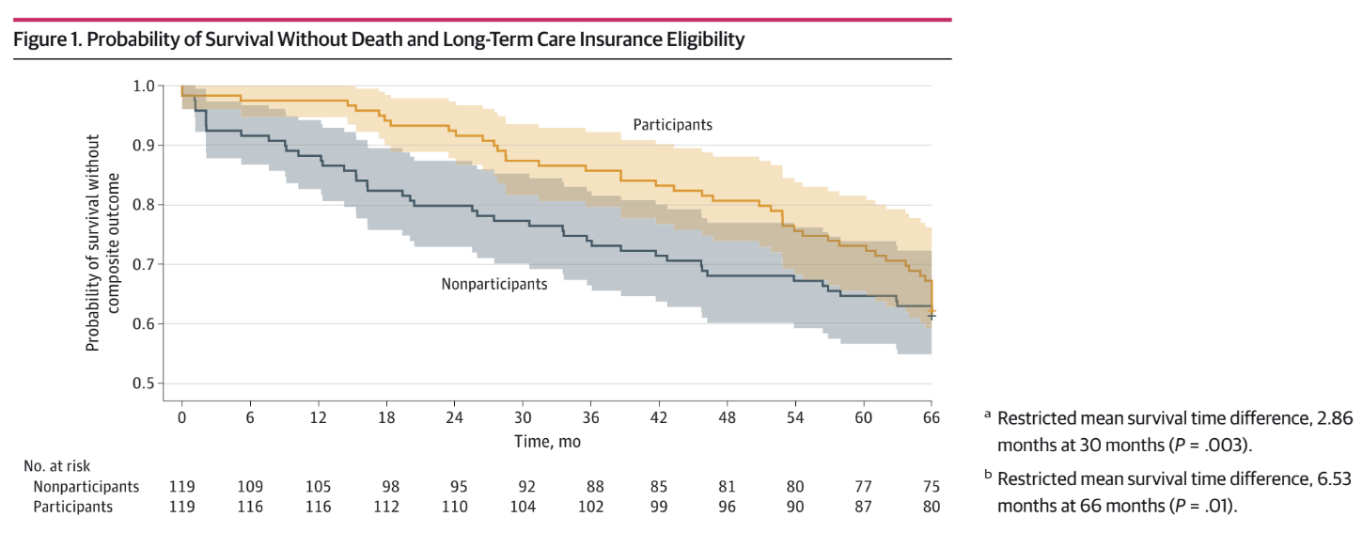
나아가, 연구팀은 명확하게 드러난 유전 신호를 기반으로 같은 유전자 변이라도 변이 위치에 따라 임상 양상이 달라지는 유전자들을 규명하였다. 예를 들어 PTEN과 같이 기능적 구조가 복잡한 유전자의 경우, 핵심 기능 부위에 변이가 생길 때 주변 부위 변이보다 임상적 영향이 더 크게 나타나는 양상이 관찰되었다. 이러한 결과는 실제 단백질 기능 변화와도 부합하며, 변이가 어떤 부위에 생기는지에 따라 임상적 해석이 달라져야 한다는 근거를 제공한다.
이번 연구는 자폐 연구에서 기존 유전체 분석이 가진 한계를 가족 단위의 정밀한 분석으로 보완하고, 유전 변이가 실제 임상에 미치는 영향을 보다 정확하게 평가할 수 있는 새로운 방법을 제시했다는 점에서 의의가 크다. 특히 신규 유전자를 발굴하고, 변이 위치에 따른 기능적 차이를 규명함으로써 자폐인의 다양한 임상 양상을 이해할 수 있는 중요한 기반을 마련했다. 이를 바탕으로 자폐인의 예후를 보다 정확하게 예측하고, 향후 맞춤형 중재 전략을 개발하는 데에도 중요한 토대가 될 것으로 평가된다.
Single-cell transcriptomics of the myeloid milieu reveals an angiogenic niche in triple-negative breast cancer
Experimental & Molecular Medicine

(해부학교실/의과학과,
공동교신저자)

(서울대학교병원 외과,
공동교신저자)

(의과학과, 공동제1저자)

(의학과, 공동제1저자)
연구진은 유방암 아형 중에서도 예후가 특히 불량한 삼중음성유방암(triple-negative breast cancer, TNBC)에서 종양 미세환경을 구성하는 골수성 면역세포에 주목하였다. TNBC는 전체 유방암의 약 15%를 차지하며, 호르몬 수용체와 HER2 발현이 없어 표적치료제가 거의 없고 세포독성 항암제에 의존하는 한계가 뚜렷한 암종이다. 이러한 불량한 예후에는 암세포 자체뿐 아니라 종양미세환경(tumor microenvironment, TME) 내 면역세포, 특히 골수성 면역세포(myeloid cell)의 역할이 크게 기여하는 것으로 알려져 왔으나, 이들의 이질성과 공간적 배치에 대한 정밀한 이해는 부족한 상황이었다.
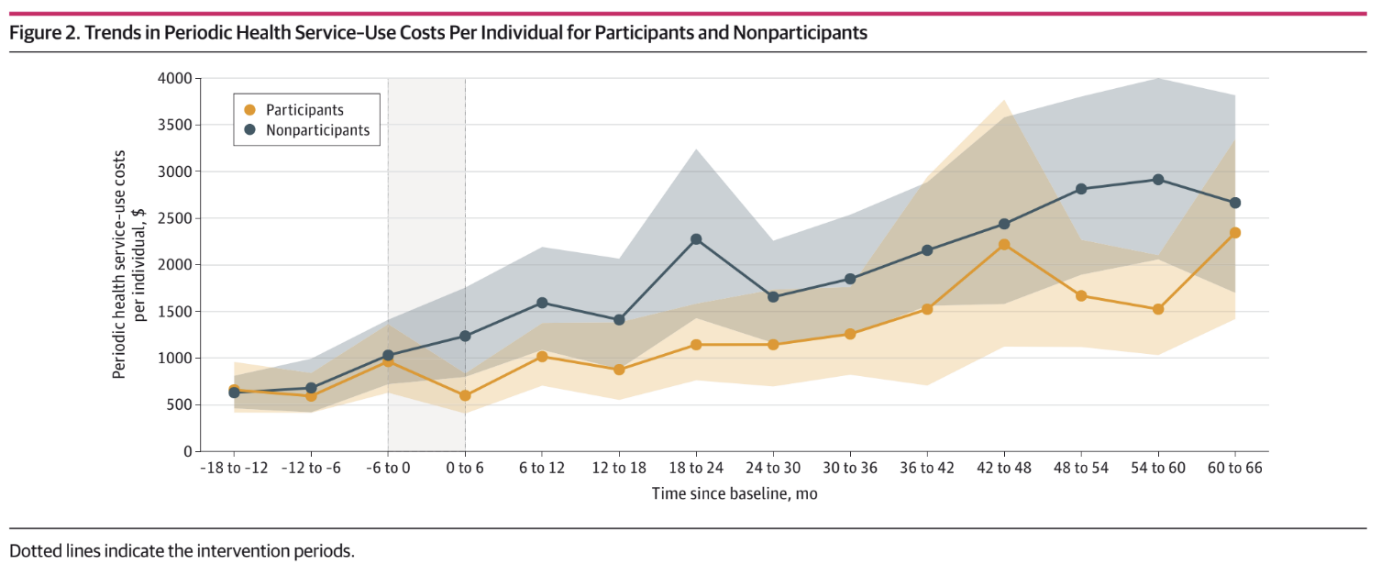
이에 본 연구팀은 단일세포 전사체 분석(single-cell RNA sequencing, scRNA-seq) 기술을 활용하여 삼중음성유방암 종양 조직 내 골수성 면역세포의 구성을 체계적으로 분석하였다. 그 결과 기능적으로 서로 다른 여러 아형의 대식세포와 호중구를 규명하였고, 그 중 SPP1+ 대식세포와 VEGFA+ 호중구가 혈관 신생(angiogenesis)에 직접 관여하는 대표적인 친종양성 아형임을 확인하였다. 이들은 암세포가 성장·전이를 위해 필요로 하는 영양분과 산소를 공급하는 혈관의 형성과 재구성을 돕는 방향으로 작용하며, 종양 진행을 촉진하는 중요한 축을 이룬다.
연구진은 나아가 공간전사체(spatial transcriptomics) 분석과 다중 면역형광염색(multiplex immunofluorescence)을 통해 이러한 골수성 면역세포 아형이 실제 종양 조직 내에서 어떻게 배치되어 있는지를 입체적으로 평가하였다. 그 결과 SPP1+ 대식세포와 VEGFA+ 호중구가 TNBC 종양 내 저산소(hypoxic) 영역에 공간적으로 밀집해 있으며, 이 부위에서 APLN+ 혈관내피세포와 함께 혈관 신생이 활발히 일어나는 국소 미세환경, 이른바 혈관신생 틈새(angiogenic niche)를 형성하고 있음을 확인하였다. 또한 저산소 환경이 골수성 전구세포를 SPP1+ 대식세포 및 VEGFA+ 호중구 아형으로 유도할 수 있음을 실험적으로 검증하여, 종양 연구에서 공간 정보와 미세환경 맥락이 왜 중요한지 다시 한번 제시하였다.
임상 데이터 분석에서도 이러한 결과는 일관되게 재현되었다. TNBC 환자군을 골수성 면역세포 아형의 비율에 따라 분류했을 때, SPP1+ 대식세포 비율이 높은 환자들은 다른 환자들에 비해 전반적인 예후가 나빴으며, 여기에 VEGFA+ 호중구가 함께 풍부한 환자군에서는 예후 악화가 더욱 뚜렷하게 관찰되었다. 이는 혈관 신생에 관여하는 특정 골수성 면역세포 아형이 단순한 동반 현상이 아니라, 환자 생존과 직결되는 중요한 생물학적 지표이자 잠재적 예후 인자임을 시사한다.
본 연구는 삼중음성유방암의 종양 미세환경을 단일세포 수준과 공간적 맥락에서 통합적으로 조망함으로써, 그동안 상대적으로 간과되었던 골수성 면역세포의 이질성과 공간적 배치가 TNBC의 예후 및 혈관신생 조절에 핵심적인 역할을 한다는 점을 규명하였다. 특히 SPP1+ 대식세포와 VEGFA+ 호중구, 그리고 APLN+ 혈관내피세포가 함께 이루는 혈관신생 틈새는 현재 치료 옵션이 제한적인 TNBC에서 새로운 면역·혈관 표적 치료 전략을 설계하는 데 중요한 기초를 제공하는 개념으로, 향후 후속 기전 연구와 표적 약제 개발의 발판이 될 것으로 기대된다.
Recombinant Dabie bandavirus as a bivalent vaccine platform inducing protective immunity against intracellular pathogens and cancer
Molecular Therapy

(미생물학교실, 교신저자)

(의생명과학단, 공동제1저자)

(의과학과, 공동제1저자)
본 연구에서는 중증열성혈소판감소증후군바이러스(SFTSV, Dabie bandavirus)의 주요 병원성 인자인 NSs 유전자를 제거하여 면역억제 기능을 차단한 ΔNSs 재조합 바이러스 기반 생약독화 백신 플랫폼을 개발하였다.
ΔNSs 바이러스는 인터페론 반응이 온전한 일반 세포에서는 증식이 억제되지만, 항원제시세포(APC)에서는 감염과 활성을 유도하여 항원제시 능력과 면역 활성화를 크게 증가시켰다. 그 결과 마우스 모델에서 강력한 항체 및 T세포 면역이 유도되었으며, 다양한 SFTSV 유전형 감염에 대해 완전한 보호 효과와 12개월 이상 지속되는 장기 면역을 확인하였다. 비인간영장류에서도 항체가, 중화능, T세포 반응이 모두 유도되어 전임상 개발 가능성을 입증하였다. 또한 본 플랫폼은 이종 항원 발현이 가능하여, OVA 또는 TSA56 항원을 탑재한 ΔNSs 바이러스가 각각 B16-OVA 흑색종 모델에서 종양 성장을 억제하고, Orientia tsutsugamushi 감염에 대해 보호 면역을 유도함을 확인하였다. 이는 ΔNSs 백신 벡터가 바이러스 감염병뿐 아니라 세포 내 세균 및 암까지 포괄하는 다목적 면역치료 플랫폼임을 보여준다. 면역학적 기전 분석 결과, ΔNSs 바이러스는 감염된 APC에서 항원제시 증가, co-stimulatory molecule 발현 증가, 세포사멸 감소를 유도하여 효과적 T세포 priming을 촉진하였다.
종합적으로, 본 연구는 SFTSV 백신이 부재한 상황에서 새로운 생약독화 전략을 제시함과 동시에, 역유전학 기반의 재조합 기술을 활용해 확장성과 범용성이 높은 백신 벡터 플랫폼을 구축하였다는 점에서 높은 의의를 갖는다. 본 ΔNSs 플랫폼은 향후 SFTSV 백신 상용화뿐 아니라 다중 감염병 대응 및 종양 면역치료 기술로 발전할 잠재력을 지닌다.