[연구동향]
Screening-detected versus interval lung cancer in the biennial Korean national lung cancer screening program: proportion, characteristics, and mortality
Journal of Thoracic Oncology

(영상의학교실, 교신저자)

(서울대학교병원 영상의학과,
제1저자)
NLST, NELSON 등 대규모 무작위 임상시험에서 폐암의 고위험군에서 저선량 CT를 이용한 폐암검진이 폐암사망률을 줄일 수 있다는 연구를 바탕으로 고위험군에서 폐암검진이 권고되며 한국에서는 2019년부터 국가폐암검진이 시행되고 있다.
간격암은 검진에서 음성 판정을 받은 후 다음 번 검진 이전에 진단되는 암으로 검진의 수행능을 평가하는 데 중요한 지표이다. 고위험군에서 시행되는 폐암검진 권고안의 대부분은 매해 저선량 CT 검진을 추천하며 우리나라의 권고안도 마찬가지이다. 하지만 2019년에 시작된 우리나라의 국가폐암검진은 현재 2년에 한 번씩 폐암검진을 제공하고 있다. 따라서 폐암검진의 주기를 결정하는 데 간격암의 발생 정도는 중요한 의미를 가진다. 이탈리아의 MILD trial에서 매해 시행하는 검진과 2년에 한 번 시행하는 검진을 비교하여 폐암사망이 양쪽 군에서 의미 있는 차이가 없었음을 보고했었고, 이 연구가 2년에 한 번 시행하는 검진의 선택에 영향을 주었었다.
본 연구는 2019년과 2020년 사이에 시행한 국가폐암검진의 기저 검사를 받은 사람들을 대상으로 검진검출폐암과 간격폐암을 비교하였다. 124,595명의 참가자 중 검진검출폐암과 간격폐암은 각각 0.56%, 0.17%에서 발견되었다. 간격폐암은 2년 이내 모든 폐암의 18.5%이었고, 폐결절이 없는 Lung-RADS 범주 1에서 65.4%가 발견되었다. 간격폐암의 위험인자는 고령, 더 많은 흡연력, 암의 병력, 폐기종, 간질성 폐이상 등이었고, 간격폐암은 검진검출폐암에 비해 모든 원인 사망률이 의미 있게 높았다.
이번 연구는 국가단위의 폐암검진에 있어 고위험군에서 2년에 한 번 폐암검진을 시행할 경우 다수의 간격암이 발생할 수 있다는 결과를 보여 주어 고위험군에서는 매해 검진을 시행하는 것이 필요하다는 중요한 증거를 제시했다.

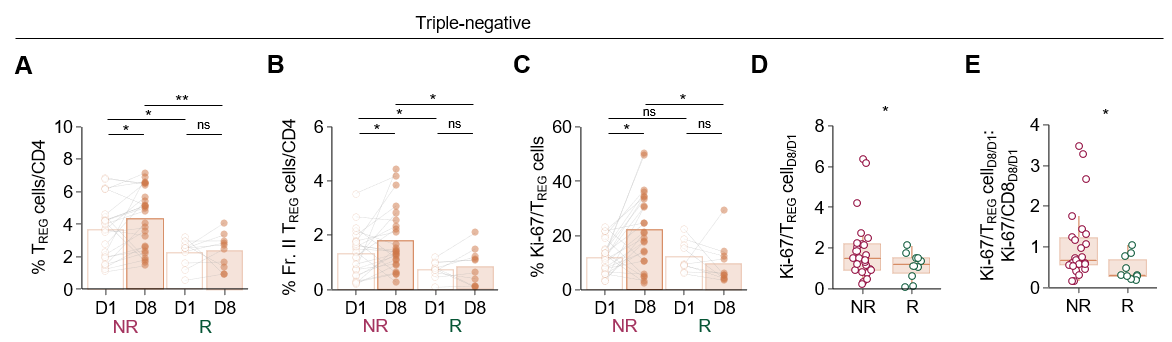
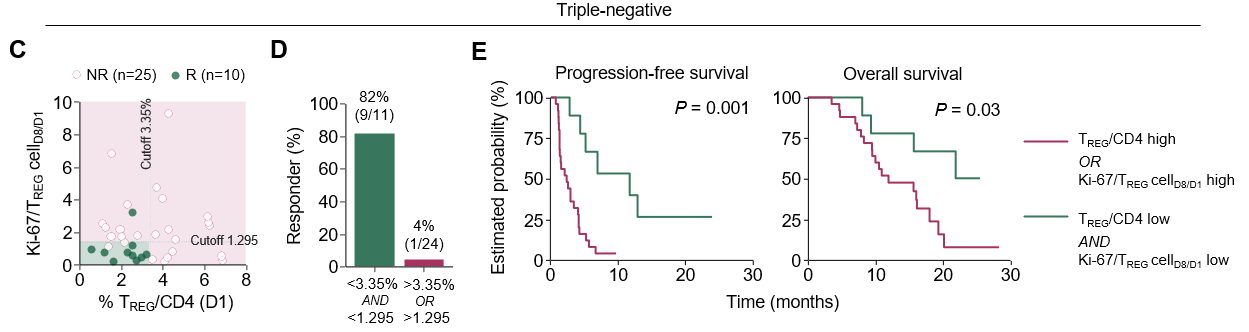
Proliferation of tumor-related regulatory T cells in circulation dictates efficacy of chemoimmunotherapy in triple-negative breast cancer
Clinical Cancer Research

(내과학교실, 공동교신저자)

(분당서울대학교병원
혈액종양내과, 공동제1저자)

(분당서울대학교병원
방사선종양학과,
공동제1저자)
서울대학교 의과대학/분당서울대학교병원과 KAIST 공동연구팀은 삼중음성유방암(triple-negative breast cancer, TNBC) 환자에서 면역항암제(anti–PD-1, nivolumab)와 항암제(eribulin) 병용치료 후 말초혈액 내 조절 T세포(regulatory T cell, TREG)의 변화를 분석하여, TREG의 증식이 치료 저항성과 연관됨을 처음으로 규명하였다.
이번 연구는 HER2 음성 전이성 유방암 환자를 대상으로 eribulin과 nivolumab 병용요법을 평가한 KORNELIA 2상 임상시험의 참여자 65명을 대상으로 치료 전후(1주일 간격) 혈액을 분석한 결과로서, 치료 후 모든 아형에서 순환 TREG 세포의 비율과 증식 활성이 증가하였고, 특히 삼중음성유방암 환자에서 종양 관련 클론형(tumor-related clonotype)을 가진 TREG 세포가 유의하게 증가하였으며, TREG 세포 증식이 높을수록 치료 반응이 불량하고 생존율이 낮은 경향을 보였다. 반면 루미널형 유방암(luminal breast cancer)에서는 이러한 상관관계가 관찰되지 않아, TREG의 종양특이적 증식이 삼중음성유방암에서 면역항암제 내성의 주요 기전임을 시사한다.
연구팀은 추가로 항-PD-L1 항체와 파클리탁셀 병용요법을 받은 삼중음성유방암 환자의 공개 단일세포 RNA 시퀀싱(single-cell RNA-sequencing, scRNA-seq) 데이터를 재분석하여, 치료 비반응군에서 증식형(proliferating) TREG 세포군이 현저히 증가함을 확인하였다.
이번 연구는 PD-1/PD-L1 면역항암제의 한계로 지적되어 온 저항 기전의 새로운 면역학적 근거를 제시하였으며, 말초혈액 TREG의 기초 비율과 치료 후 증식 정도가 면역항암 병용요법의 반응 및 예후를 예측할 수 있는 새로운 바이오마커로 활용될 가능성을 보여 주었다.
이 연구는 보건복지부 국가암정복추진연구개발사업 및 한국연구재단 바이오·의료기술개발사업의 지원을 받았으며, 공동교신저자는 서울대학교 의과대학 내과학교실 혈액종양내과의 김지현 교수와 KAIST 의과학대학원 신의철 교수이다.
Combined effects of statin medication adherence and fine particulate air pollution on cardiovascular disease among older adults
The Journals of Gerontology: Series A

(의과학과/가정의학교실,
교신저자)

(의과학과, 제1저자)
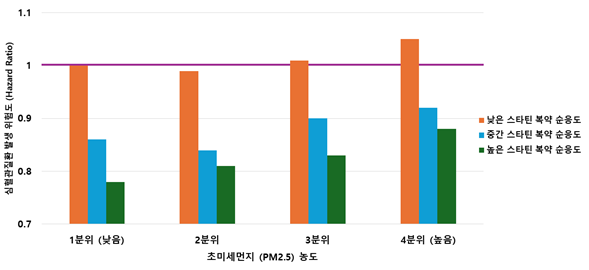
65세 이상 고령 인구에서 초미세먼지(PM2.5)에 노출된 경우에도 스타틴(statin) 복약 순응도가 높으면 심혈관질환 발생 위험이 낮을 수 있다는 연구 결과가 나왔다. 특히, 높은 초미세먼지 노출 환경에서 스타틴 복약 순응도가 낮은 고령자의 심혈관질환 위험이 증가하는 반면, 높은 스타틴 복약 순응도는 초미세먼지 농도 수준과 관계없이 심혈관질환 예방 효과가 일관되게 나타났다.
초미세먼지는 심혈관질환 발생 위험을 높이는 주요한 위험 요인으로 보고되고 있으며, 고령 인구는 초미세먼지의 유해 영향에 민감하고 취약한 집단으로 알려져 있다. 스타틴은 이상지질혈증 치료 및 심혈관질환 예방에 널리 처방되는 약물이며, 복약 순응도 관리가 중요하다.
서울대학교 의과대학 박상민 교수 연구팀은 국민건강보험공단 빅데이터를 활용하여 65세 이상 고령 인구 약 79만 명을 대상으로 한 연구에서 초미세먼지 농도가 높은 지역에 거주하더라도 스타틴 복약 순응도가 높으면 심혈관질환 발생 위험이 낮아질 수 있음을 시사하는 연구 결과를 발표했다. 초미세먼지 농도는 4분위로 구분하였으며, 스타틴 복약 순응도는 약물 소지 비율(medication possession ratio, MPR)을 바탕으로 낮은(MPR<0.5), 중간(0.5≤MPR<0.8), 높은(MPR≥0.8) 복약 순응도로 정의하였다.
연구 결과, 낮은 수준의 초미세먼지에 노출되고 스타틴 복약 순응도가 낮은 군에 비해 높은 수준의 초미세먼지에 노출되고 스타틴 복약 순응도가 낮은 군의 심혈관질환 발생 위험은 5% 높았고, 높은 수준의 초미세먼지에 노출되고 스타틴 복약 순응도가 높은 군의 심혈관질환 발생 위험은 12% 낮았다.
본 연구는 고농도 미세먼지 노출 환경에서도 스타틴 복약 순응도가 높은 경우 고령 인구의 심혈관질환 발생 위험을 낮출 수 있고, 순응도가 낮은 경우에는 심혈관질환 발생 위험 증가와 연관성이 있음을 규명하였다. 이는 고령 인구 대상 심혈관질환 예방 전략 수립의 기초 근거로 활용될 수 있을 것으로 기대된다.
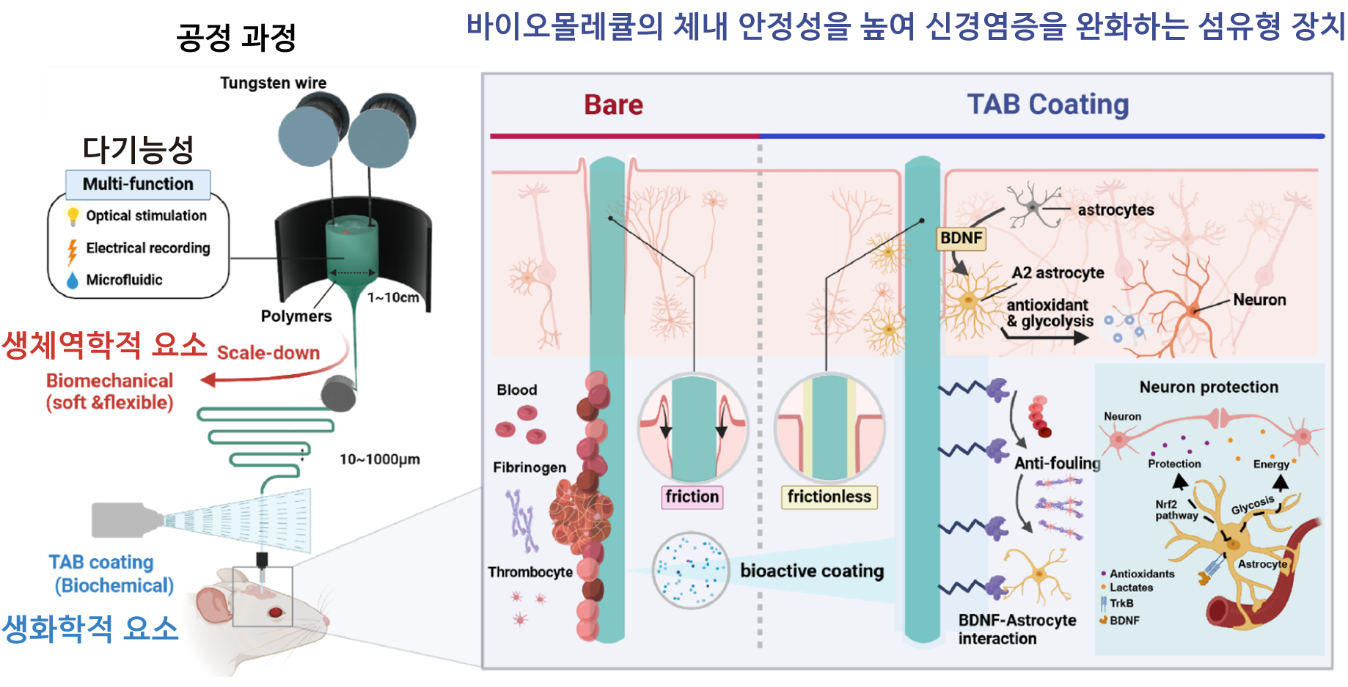
Bioadaptive liquid-infused multifunctional fibers for long-term neural recording via BDNF stabilization and enhanced neural interaction
Science Advances

서울대학교 의과대학 의과학과 및 첨단융합학부 소속 박성준 교수 및 연구팀이 연세대학교 서정목 교수 연구팀과 공동으로 다기능성 유연 신경섬유에 Targeting-specific interaction And Blocking nonspecific adhesion (TAB) 코팅을 적용하여 장기적인 장치 안정성과 신경 신호 기록 품질을 향상시키는 데 성공했다.
기존의 삽입형 신경 인터페이스는 수술 과정에서 신경조직의 손상을 유발하고, 이후 염증과 면역 반응으로 장치 기능이 점차 저하되는 한계를 가지고 있었다. 또한 이를 줄이고자 도입했던 기존의 표면 코팅기술이나 생체분자 활용 전략은 신경세포와의 상호작용을 방해하거나 체내에서 빠르게 분해되는 문제가 있어 장기적으로 신경 인터페이스의 안정성을 확보하는 데 어려움이 있었다.
연구진은 이러한 문제를 해결하기 위해 열 인발 공정을 통해 제작한 다기능성 고분자 기반 섬유 표면에 뇌유래신경영양인자(brain-derived neurotrophic factor, BDNF)와 윤활층을 결합한 TAB 코팅을 적용했다. TAB 코팅은 신경세포와 성상교세포와의 선택적 상호작용을 촉진하면서, 면역 관련 물질의 비특이적 부착은 차단해 염증 반응과 글리아 캡슐화를 억제한다. 이 섬유는 신경세포와 상호작용하며 신경친화적 환경을 조성하는 데에 기여하는 것으로 나타났다. 연구팀은 in vitro에서 ELISA, Western blot, 세포 형태 분석(cellular morphology)을 통해 이를 확인했고, in vivo에서는 면역조직화학(immunohistochemistry) 및 단일 신경세포 활동(single neuron activity) 분석을 통해 장기적인 신경 기능 유지와 생존을 검증했다. 또한 윤활층은 삽입 시 조직에 가해지는 힘과 스트레스를 줄여 급성 손상과 만성 미세 움직임 손상을 최소화했다.
실제 생체 내 실험 결과, TAB 코팅 섬유는 1년 이상 안정적인 고해상도 신경 신호 기록이 가능했으며, 장치 주변의 신경세포 유지율도 크게 향상됐다. 이 기술은 뇌-기계 인터페이스(BMI), 신경 보철, 신경조절 치료 등 다양한 신경공학 분야에 적용이 가능한 차세대 솔루션으로 평가된다.
이번 연구는 신경염증을 완화시킴으로써 신경 장치의 장기적 안정성을 획기적으로 개선할 수 있는 전략을 제시한 사례로, 향후 뇌-기계 인터페이스 및 신경보철 기술 발전에 중요한 발판이 될 것으로 기대된다.
Trained immunity induced by DAMPs and LAMPs in chronic inflammatory diseases
Experimental & Molecular Medicine

(미생물학교실/의과학과,
공동교신저자/공동제1저자)

(의학연구원 감염병연구소,
공동교신저자/공동제1저자)
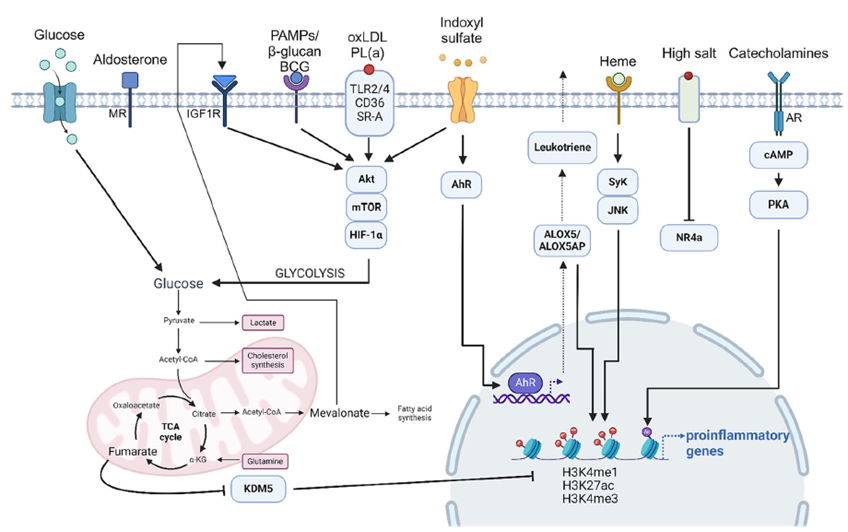
면역계는 선천면역과 적응면역으로 구분되며, 전통적으로 면역기억은 적응면역에만 존재하는 고유한 기능으로 이해되어 왔다. 그러나 진화적 관점에서 면역은 병원체, 유해 물질에 맞서는 중요한 생존 전략으로, 전체 생물 종의 1–2%에 불과한 척추동물에만 존재하는 적응면역에 면역기억이 한정된다는 것은 비합리적이라는 의문이 제기되어 왔다. 최근 선천면역세포가 초기 자극 후 비특이적 이차 자극에 대해 증강된 반응을 보이는 ‘훈련면역(trained immunity)’ 현상이 규명되면서, 면역기억이 보다 원시적이며 보존된 진화 전략의 한 형태로 주목받고 있다. 훈련면역은 항원특이성과 clonal expansion에 기반한 적응면역과 달리, 선천면역세포와 조혈모세포 수준에서의 후생유전학적, 대사적 리프로그래밍(세포 기능 재설정)을 통해 지속적인 기능 변화를 형성하는 비특이적 기억 기전으로 설명된다.
초기 연구는 병원체 연관 분자(pathogen-associated molecular patterns, PAMPs)에 의해 유도되는 훈련면역이 숙주 방어를 강화하는 진화적으로 유리한 효과에 초점을 두었으나, 최근에는 조직손상 관련 분자(damage-associated molecular patterns, DAMPs)와 생활습관 연관 분자(lifestyle-associated molecular patterns, LAMPs)에 의해 유도되는 비감염성 훈련면역이 만성적으로 활성화될 경우, 오히려 심혈관질환, 만성 신부전, 류마티스 질환, 노화 등 만성 염증성 질환의 위험을 높이는 ‘진화적 대가’를 초래할 수 있음이 제시되고 있다. 본 리뷰는 산화된 저밀도지단백(oxidized LDL), 고지방·고당식, 요독증 독소, 헴(heme), 카테콜아민(catecholamine), 알도스테론(aldosterone), 고염식(high-salt diet) 등을 포함한 다양한 DAMPs/LAMPs 유도 훈련면역의 분자기전을 정리하고, 특히 본 실험실에서 발표한 인독실 황산염(indoxyl sulfate, IS)에 의해 유도되는 훈련면역의 기전을 중심으로 만성신장병과의 연관성을 심도 있게 소개한다.
더 나아가 골수 조혈모세포 수준에서 장기적인 골수성 편향(myeloid skewing)을 유도하는 ‘중심훈련면역(central trained immunity)’ 개념을 통해, 훈련면역이 개별 자극을 넘어 전신 염증 환경을 재구성하는 진화적으로 보존된 기전임을 조명한다. 본 논문은 훈련면역을 선천·적응면역을 잇는 진화적 면역기억 축으로 재해석하고, 이를 표적으로 하는 조절 전략이 만성 염증성 질환의 새로운 치료 및 예방 패러다임이 될 수 있음을 제안한다.

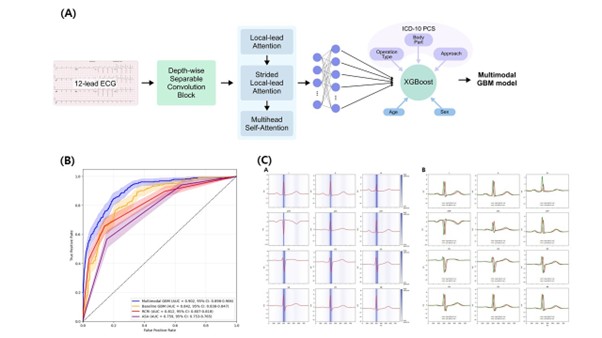
Multimodal deep learning to predict postoperative major adverse cardiac and cerebrovascular events after non-cardiac surgery
International Journal of Surgery

(마취통증의학교실, 교신저자)

(마취통증의학교실, 제1저자)
본 연구는 서울대학교 의과대학 마취통증의학교실 연구팀이 수행한 것으로, 비심장수술 후 30일 이내 주요 심뇌혈관 합병증을 예측하는 다중모달 딥러닝 모델을 개발하였다. 연구팀은 2006~2020년 서울대학교병원에서 시행된 약 16만 명의 수술 환자 데이터를 활용하였으며, 심전도 파형, 인구학적 정보, 수술 코드(ICD-10)를 결합하는 방식으로 최소 변수 입력만으로 높은 예측 성능을 확보했다. 모델은 기존 Revised Cardiac Risk Index (RCRI) 및 ASA 신체분류지표 대비 우수한 성능을 보였으며(AUROC 0.902), 특히 QRS complex의 형태학적 변화 등 미세한 전기생리 신호를 학습하여 기존 평가지표로는 포착이 어려운 위험 패턴을 식별하는 것으로 확인되었다. 이 모델은 임상의가 객관적으로 활용할 수 있는 단순하고 효율적인 수술 전 위험평가 도구로서, 실제 임상 적용 가능성과 확장성을 보여주었다. 본 연구는 의료 인공지능을 수술 전 평가에 접목함으로써 환자 안전 강화와 맞춤형 마취 및 수술 계획 수립에 기여할 것으로 기대된다.
Mitochondrial-encoded peptide MOTS-c prevents pancreatic islet cell senescence to delay diabetes
Experimental & Molecular Medicine

서울대학교 의과대학 내과학교실 조영민 교수 연구팀은 미토콘드리아에서 생성되는 펩타이드인 mitochondrial open reading frame of the 12S rRNA-c (MOTS-c)가 췌도 β세포의 노화를 억제함으로써 당뇨병의 발생과 진행을 늦출 수 있음을 규명하였다.
연구팀은 미토콘드리아 유래 단백질이 세포 노화에 미치는 영향을 분석하는 과정에서, MOTS-c 수치가 노화 및 당뇨병 상태에서 현저히 감소함을 발견하였다. 노화된 생쥐의 췌도세포에 MOTS-c를 투여한 결과, 노화 표지자인 p16, γ-H2AX, IL-1β 등의 발현이 억제되고, β세포 기능과 포도당 내성이 개선되었다.
특히, MOTS-c는 미토콘드리아-핵 간 신호전달을 조절하여 아스파르테이트–글루탐산 대사경로(aspartate–glutamate transport) 및 mTOR 신호경로를 억제함으로써 세포 노화를 완화하는 것으로 나타났다. 또한, 제1형 당뇨병 동물모델(NOD 생쥐)과 인슐린 수용체 억제제(S961)로 유도된 제2형 당뇨병 모델에서 모두 췌도세포의 노화를 예방하고 혈당 상승을 억제하였다.
이번 연구는 노화와 당뇨병의 공통 병리기전으로 주목받는 췌도세포 노화(islet cell senescence)를 미토콘드리아 유래 펩타이드 수준에서 조절할 수 있음을 처음으로 입증한 것이다. 더불어, MOTS-c의 순환농도가 제2형 당뇨병 환자에서 유의하게 낮다는 점을 확인하여, MOTS-c가 향후 ‘항노화 당뇨병 치료제(senotherapeutic for diabetes)’로 개발될 잠재력을 제시하였다.
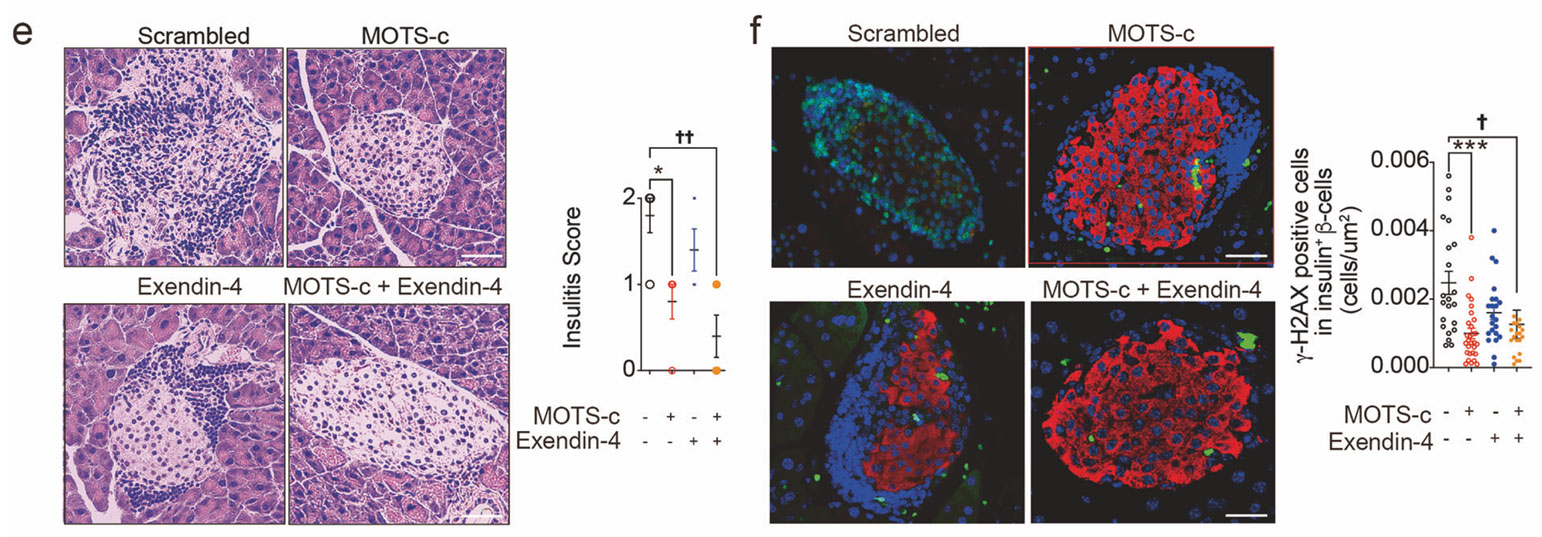
B. 마찬가지로 노화 마커인 γ-H2AX 발현이 MOTS-c와 exendin-4 투여로 감소하고 있음. >
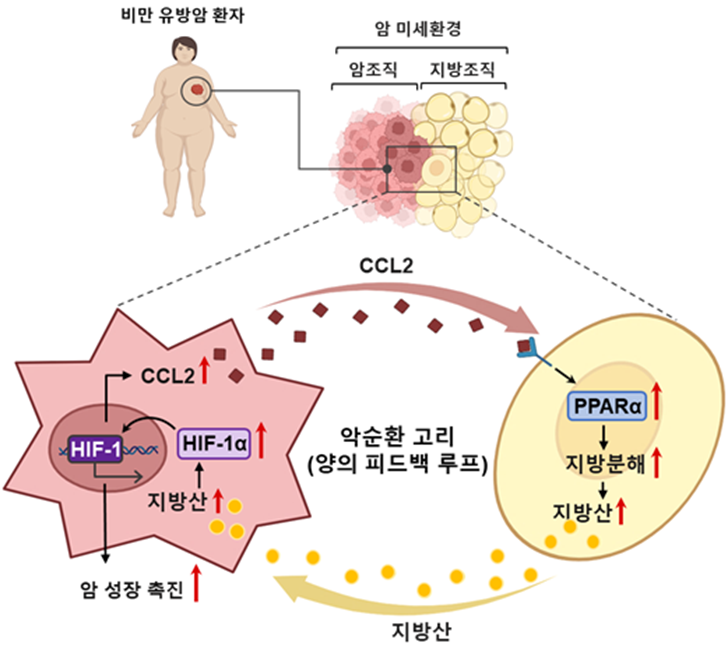
Cancer manipulates adjacent adipose tissue to exploit fatty acids via HIF-1α/CCL2/PPARα axis: a metabolic circuit to support tumor progression
Advanced Science

(생리학교실, 교신저자)

(의과학과, 제1저자)
비만은 단순한 체중 증가를 넘어 여러 암의 발생과 진행을 촉진하는 주요 요인으로 알려져 있다. 유방암, 대장암, 췌장암 등 여러 암종에서 체질량지수(BMI)가 높을수록 암의 발생률과 재발률이 높아진다는 연구들이 이를 뒷받침한다. 기존에는 이러한 현상이 주로 호르몬 불균형이나 만성 염증 반응 때문이라고 여겨졌으나, 본 연구는 비만이 암을 촉진하는 새로운 대사적 메커니즘을 규명하였다. 즉, 암세포가 주변 지방세포를 조종해 지방산을 빼앗고 이를 통해 암 성장에 필요한 신호경로를 활성화한다는 것이다.
연구진은 산소 투과성이 높은 3차원 공동배양 시스템을 개발하여 실제 암 미세환경을 모사하고, 암세포와 지방세포의 직접적인 상호작용을 정밀하게 관찰하였다. 그 결과, 암세포는 CCL2 (C-C motif chemokine ligans 2)라는 신호물질을 분비해 지방세포의 지방대사 조절 전사인자인 PPARα (peroxisome proliferator-activated receptor α)를 활성화시키고, 이로 인해 지방분해(lipolysis)가 촉진되어 지방조직에 저장된 지방산이 방출된다는 사실을 발견했다. 방출된 지방산은 다시 암세포로 흡수되어 암 성장조절에 필수적인 전사인자 HIF-1α (hyposia-inducible factor 1α) 신호를 활성화시키며, 증가된 HIF-1α는 다시 CCL2의 분비를 증가시키는 ‘자가 증폭 회로(positive feedback loop)’를 형성한다. 이러한 순환 구조는 지방조직의 소모를 동반하며 암세포의 성장과 전이를 가속화하는 특징적인 대사적 변화로 나타났다.
이 메커니즘은 단순히 세포 배양 수준의 현상이 아니라 비만 유도 생쥐 모델과 유방암 환자의 실제 조직 분석에서도 동일하게 확인되었다. 비만 생쥐에서 암 주변의 지방조직이 줄어들었고, 이와 함께 암의 성장률이 크게 증가했다. 그러나 CCL2를 중화하는 항체(nAb-CCL2, neutralizing antibody to CCL2)를 투여했을 때, 지방조직내의 PPARα 가 줄어들며 지방분해가 억제되었고, 이때 암 조직 내의 HIF-1α와 CCL2 신호도 감소하며 암의 성장이 현저히 줄어드는 결과를 보였다. 이는 암과 지방조직 간의 대사적 소통이 비만 관련 암의 진행을 실제로 주도하는 핵심 원인임을 명확히 입증한 결과이다.
본 연구의 가장 큰 의의는 비만 상태에서 활성화되는 ‘HIF-1α/CCL2/PPARα 축’이 암세포와 지방세포 사이의 대사적 상호작용을 매개한다는 사실을 분자 수준에서 규명한 데 있다. 이는 기존의 염증 중심적 관점에서 벗어나 비만과 암을 연결하는 대사적 관점의 새로운 패러다임을 제시한다. 특히 CCL2 신호를 차단하면 비만 환경에서의 암의 성장을 억제할 수 있다는 점은 향후 대사 기반 항암 치료나 병용 요법으로의 발전 가능성을 시사한다.
결과적으로 본 연구는 지방조직을 단순한 에너지 저장소가 아닌, 암의 성장을 조력하는 대사 기관으로 재정의하며 암과 비만의 관계를 통합적으로 이해할 수 있는 전환점을 마련했다. 이는 비만환자의 암 예방·진단·치료의 전 과정에 새로운 전략을 제시할 수 있는 근거를 제공한다. 나아가 암세포의 생존 전략이 주변 조직의 대사를 어떻게 재구성하는지에 대한 근본적 통찰을 제시함으로써, 향후 정밀의학적 항암 접근법의 발전에 중요한 단서를 제공할 것으로 기대된다.