[연구동향]
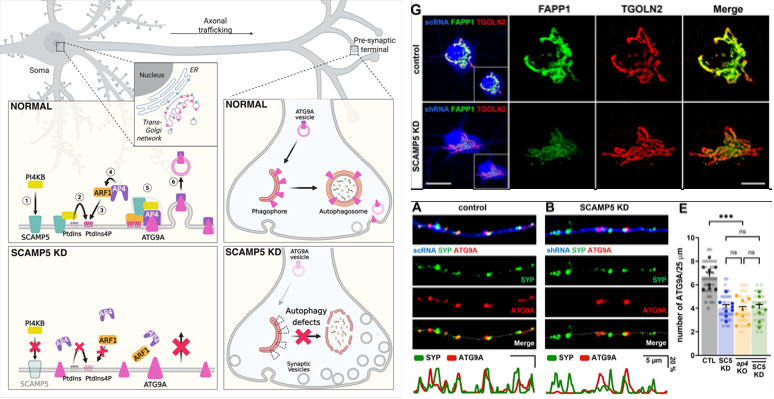
Human MAIT cells undergo clonal selection and expansion during thymic maturation and aging
Experimental & Molecular Medicine

(심장혈관흉부외과학교실,
공동교신저자)

(약학대학 제약학과/
공동교신저자)
본 연구는 서울대학교 의과대학 흉부외과학교실 곽재건 교수 연구팀과 서울대학교 약학대학 이유정 교수(서울의대 56회 졸업) 연구팀의 협력으로 수행되었다. 연구진은 사람 흉선에서 면역계의 중심적인 역할을 하는 T 세포의 특수한 아형인 선천성 T 세포가 소아 및 성인의 흉선에서 어떻게 발달하는지를 분석하였다. 선천성 T 세포는 MAIT (mucosal-associated invariant T), iNKT (invariant natural killer T), γδ T 세포로 이루어진 집단으로 감염, 염증, 암 등에서 광범위한 역할을 하는 것으로 알려져 있다. 연구진은 이들의 발달 과정을 깊이 있게 이해하고자 사람 흉선에서 이 세포들을 추출하여 연령별로 단일세포전사체 분석, TCR 다양성 분석을 통해 비교 분석하였다.
그동안 MAIT 세포는 말초 조직에서의 역할과 기능은 비교적 활발히 연구되어 왔으나, 흉선 내에서 어떻게 발달하고 클론 다양성을 형성하는지는 충분히 규명되지 않았다. 또한 MAIT, iNKT, γδ T 세포와 같은 선천성 T 세포들의 발달 과정을 동일한 틀에서 비교한 연구 역시 없었다. 이번 연구는 신생아부터 성인(2주~56세)에 이르는 37개의 흉선 샘플을 포함하여 선천성 T 세포의 발달 과정을 전 생애적 관점에서 규명한 최초의 연구라는 점에서 의의가 크다. 특히 MAIT 세포는 성숙 과정에서 TCR 다양성이 줄어들고 특정 클론이 선택적으로 확장되며 조직상주 특성을 획득하는 반면, iNKT 세포와 γδ T 세포는 흉선 내에서 발달이 상대적으로 제한되는 상반된 양상을 보였다.
이 연구는 MAIT 세포가 다른 선천성 T 세포와 유사한 클론 선택 과정을 거치면서도 독자적인 발달 경로를 가지며, 성인기에도 흉선에서 확장 및 축적되는 특성을 지닌다는 사실을 새롭게 제시하였다. 이러한 발견은 MAIT 세포가 자가면역 및 감염성 질환에서 수행하는 역할을 이해하는 데 중요한 학문적 토대를 제공하며, 향후 조직상주 면역세포를 활용한 백신 및 면역치료 전략 개발로 이어질 수 있는 임상적 응용 가능성을 보여 준다.
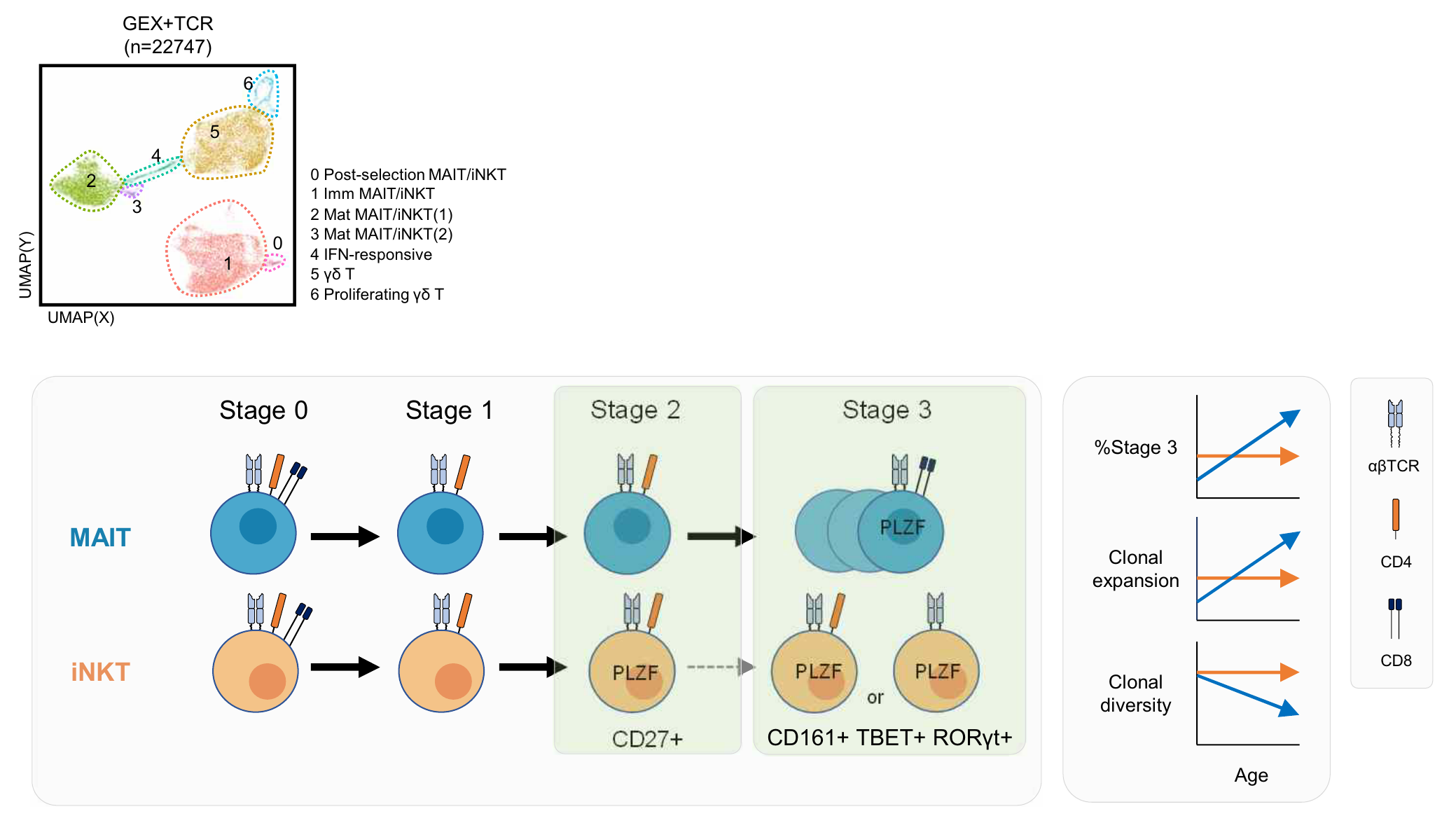
Multimodal AI for risk stratification in autism spectrum disorder: integrating voice and screening tools
npj Digital Medicine

본 연구는 서울대학교 의과대학 정신과학교실 김붕년 교수, 세브란스병원 소아정신과 천근아 교수, 신경외과 김휘영 교수 연구팀이 공동으로 수행한 연구로, 생후 18~48개월 아동 1,242명의 부모-아동 상호작용 음성과 표준화된 선별도구(M-CHAT, SCQ-L, SRS) 응답을 통합 분석하여 초기 자폐스펙트럼장애 선별을 위한 2단계 다중모달 인공지능(AI) 프레임워크를 개발·검증한 연구이다.
자폐스펙트럼장애(autism spectrum disorder, ASD)는 제한적 반복행동과 사회적 의사소통의 어려움으로 특징지어지며, 발달 과정에서 나타나는 만큼 조기 진단과 개입이 언어 발달과 사회적 상호작용 능력 향상에 중요하다. 그러나 부모가 증상을 알아채기 어렵고 병원 방문이 늦어지는 등의 이유로 조기 진단이 지연되는 경우가 많다.
이번 연구에서는 스마트폰 기반 모바일 앱을 통해 가정에서 '이름 부르기 반응', '행동 따라하기', '공놀이', '상징 놀이', '도움 요청하기' 등의 짧은 동영상 과제를 수행하고 아이의 음성을 녹음한 데이터를 수집, 부모가 작성한 설문 응답(M-CHAT, SCQ, SRS)과 함께 AI 모델에 입력해 분석하였다. 기존 설문 점수만 이용한 선별 정확도가 약 70% 수준인 것에 비해, 실제 음성 데이터(톤·리듬·패턴 등)를 함께 사용해 다차원적으로 분석함으로써 1단계에서 정상 발달 아동(typically developing, TD)과 위험군을 94% 이상의 정확도로 구분하고, 2단계에서 고위험군과 실제 ASD 아동을 85% 정확도로 구분하였다.
모델의 예측은 국제적으로 표준화된 ADOS-2 검사 결과와도 80% 일치했고, 위험도 범주화 결과 역시 ADOS-2 기반 중증도 분류와 79.6% 일치하였다. 이러한 결과는 조기 개입이 필요한 아동을 보다 정밀하게 선별하고, 불필요한 진료 지연을 줄이며, 전문가 진단 이전에 가정에서 쉽게 접근할 수 있는 디지털 검사 도구로 활용될 가능성을 보여 준다.
본 연구를 통해 개발된 AI는 실제 가정에서도 활용 가능해 조기 진단율을 높이고 더 좋은 치료 결과로 이어질 수 있으며, 조기 선별의 접근성과 정확성을 높여 조기 개입을 가능하게 하고 임상 현장의 부담을 줄이는 데 기여할 수 있을 것으로 기대된다.
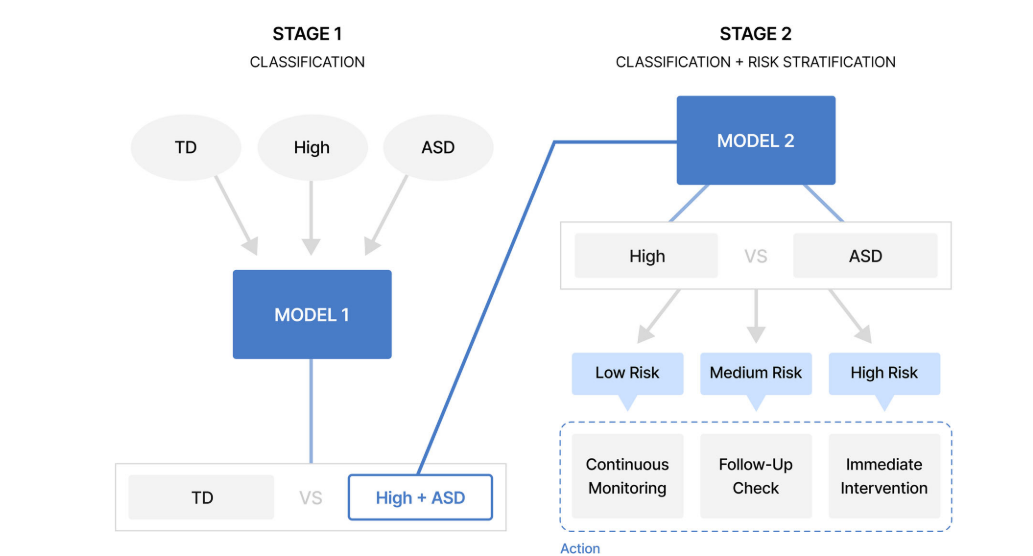
Young adults with metabolic dysfunction–associated steatotic liver disease have an increased risk of early-onset cancer: a nationwide cohort study differentiating the risk of 23 site-specific cancers
Clinical Gastroenterology & Hepatology

(내과학교실, 교신저자)

(내과학교실, 공동제1저자)
지방간질환(steatotic liver disease, SLD)은 대사이상 지방간(MASLD)과 대사이상 및 알코올간질환(MetALD) 등을 포함하는 개념으로, 청년층에서도 유병률이 증가하고 있다. 최근 여러 연구에서 SLD가 간암뿐 아니라 위장관·신장 등 다양한 장기의 암 위험과 관련될 가능성이 제기되고 있으나, 청년층을 대상으로 한 대규모 장기별(23개) 분석은 제한적이었다.
따라서 본 연구에서는 젊은 성인(20~39세) 한국인 코호트에서 지방간 유무 및 하위분류(MASLD, MetALD, ALD)에 따른 조기 발병 암(50세 미만) 위험을 평가하고, 전체 암 및 부위별(23개 장기) 암 위험을 분석하였다.
국가건강검진을 수행한 2,200만여 명을 전향적으로 추적 관찰하였으며, 지방간이 없는 군 대비 MASLD와 MetALD에서 조기 발병 암 위험이 유의하게 증가했다. 부위별 분석에서는 간암 및 위장관암 등 비만과 연관된다고 알려진 암종의 위험 증가가 두드러졌다.
본 연구는 젊은 성인 지방간 환자에서 조기 발병 암 위험이 증가함을 최초로 규명하였다. 또한 비만하거나 지방간을 동반한 젊은 성인에서 암 선별검사 및 예방 전략을 조기에 고려할 필요성에 대한 근거를 제공한다.
Piezo1-mediated mechanotransduction regulates the translational activity, function and lung pathogenicity of group 2 innate lymphoid cells
Signal Transduction & Targeted Therapy

(의과학과, 교신저자)

(의과학과, 제1저자)
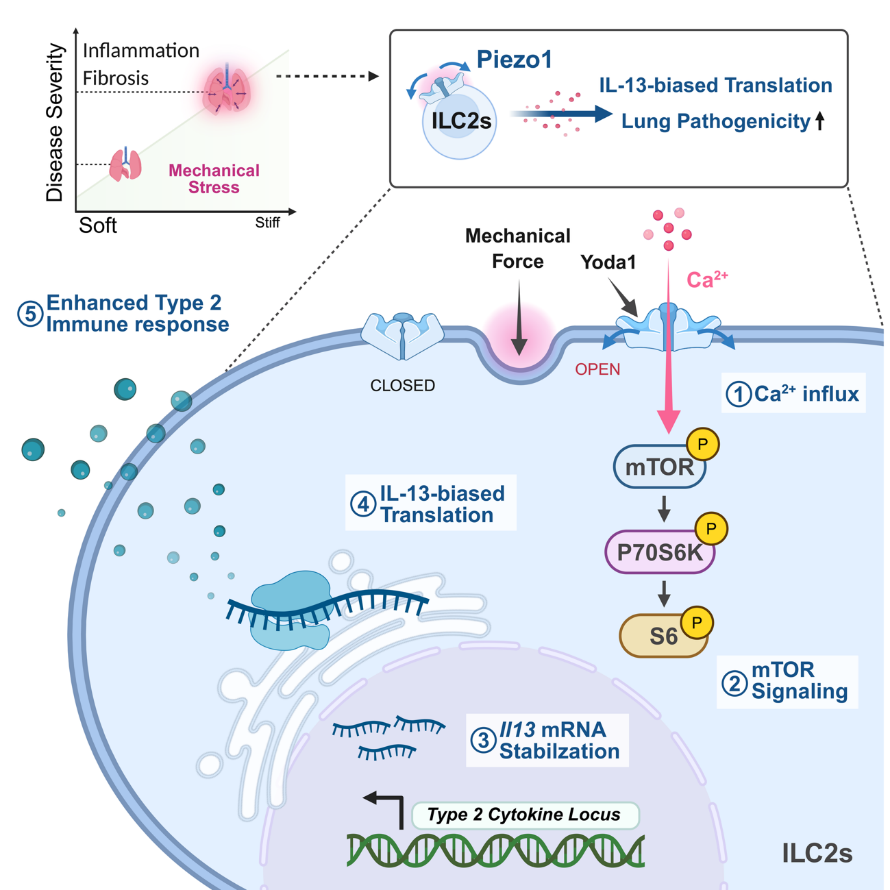
폐는 우리가 하루에 약 2만 번 이상 숨을 쉬며 끊임없이 팽창과 수축을 반복하는 장기이다. 이렇게 호흡으로 인한 기계적 자극은 폐 세포와 면역환경에 지속적으로 영향을 미치지만, 면역세포가 이 물리적 힘을 어떻게 감지하고 반응하는지는 잘 알려지지 않았다.
이번 연구에서는 폐의 주요 면역세포인 선천성 림프구세포(ILC2)가 ‘압력 센서’ 역할을 하는 Piezo1 이온채널을 통해 기계적 힘을 감지한다는 사실을 규명했다. 폐 조직이 단단해지거나(예: 염증, 섬유화) 반복되는 호흡으로 기계적 스트레스가 커지면 Piezo1이 열리고, 칼슘 신호가 유입되어 mTOR 경로가 활성화된다. 이 과정은 단순한 유전자 발현 증가가 아니라, 번역 단계에서 IL-13 단백질을 선택적으로 많이 만드는 방향으로 ILC2를 재프로그래밍한다. Piezo1을 ILC2에서 제거한 마우스는 IL-33 유발 폐염증, 알레르기성 천식, 폐섬유화 모델 모두에서 염증과 섬유화가 크게 줄었다. 또한 mTOR 억제제 라파마이신을 투여했을 때도 단백질 합성과 사이토카인 생산이 억제되어 질병이 완화되었다.
이 연구는 기계적 자극 → 면역세포 반응 → 질병 악화라는 연결고리를 분자 수준에서 제시하며, ILC2 기능이 단순 전사 조절이 아니라 번역 단계에서 정밀하게 조절될 수 있다는 새로운 개념을 밝혀냈다. 무엇보다 Piezo1–mTOR 축을 차단하면 폐질환이 호전될 수 있음을 입증하여, 난치성 천식·섬유화·COPD 치료의 새로운 표적을 제시하였다.
Fully biocompatible, thermally drawn fiber supercapacitors for long-term bio-implantation
Nature Communications

(첨단융합학부/의과학과,
공동교신저자)

(의학연구원, 공동제1저자)
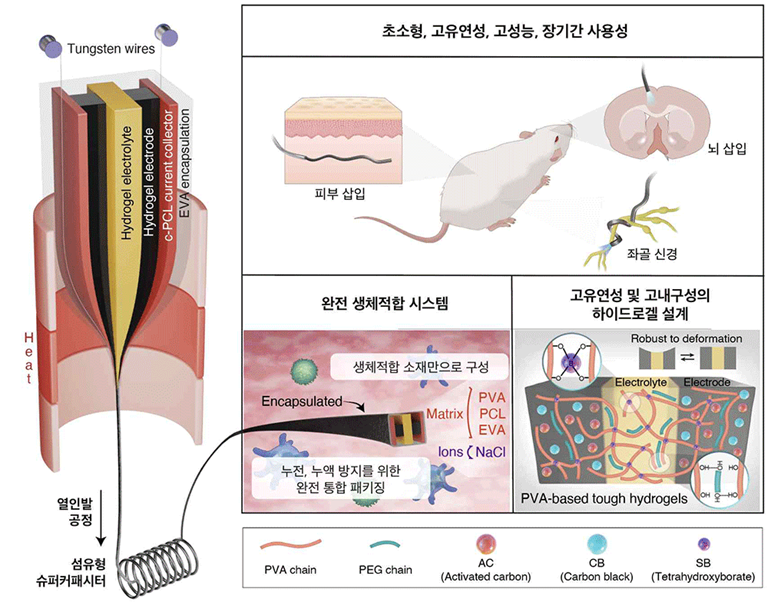
서울대학교 의과학과 및 첨단융합학부 박성준 교수 연구팀(서울대학교 의학연구원 전성하 박사, KAIST 바이오및뇌공학과 서현엽·김예지 박사과정)과 경희대 식물·환경신소재공학과 이정태 교수 연구팀 등으로 구성된 공동연구진이 완전 생체적합 소재로 만든 섬유형 슈퍼커패시터를 개발하고, 이를 통해 자유 보행 동물모델에서 생체적합 에너지 저장 장치의 안정적 구동을 세계 최초로 5주 이상 구현하였다.
현재 심박조율기, 신경자극기, 헬스케어 센서, Brain-Computer Interface (BCI) 시스템 등 대부분의 이식형 전자기기는 리튬 기반 배터리를 전원으로 사용한다. 리튬 기반 배터리는 소재의 독성·발열·누액 등 안전성 문제가 있고, 유연성의 부족으로 인해 체내의 복잡한 구조나 움직임에 적응하지 못해 체내의 장기나 조직에 물리적 스트레스를 부가할 수 있었다. 따라서 바이오 목적의 차세대 에너지 저장 장치는 소재적으로 안전하면서도 체내의 복잡한 해부학적 구조에 안정적으로 적응 가능한 높은 구조적 유연성을 필요로 한다.
연구팀은 이러한 한계를 극복하기 위해 PVA/PEG/Borax 하이드로겔 기반의 고인성·자가치유 전극·전해질을 개발하였다. 또한 열인발(thermal drawing) 공정을 이용하여, 개발된 전극과 전해질 그리고 고분자 기반의 집전체와 패키징을 수백 μm 직경의 단일 섬유 형태로 통합하여, 체내 삽입에 적합한 초소형·고유연성의 구조를 구현하는 데 성공하였다. 모든 구성 요소가 완전 생체적합 소재로 제작되어 장기 이식 시 소재적 안전성을 확보한다.
개발된 섬유형 슈퍼커패시터는 뛰어난 유연성과 내구성을 바탕으로 굽힘·비틀림·매듭 등 다양한 기계적 변형과 복잡한 체내 구조 속에서도 전기화학 성능 저하 없이 안정적으로 작동한다. 연구팀은 개발된 생체적합 에너지 저장 장치를 이용하여, 자유롭게 움직이는 실험용 쥐의 체내에서 LED를 구동하는 것으로 안정성과 실용성을 검증하였고, 말초신경(좌골신경) 및 중추신경(대뇌신경) 대상 광유전학적 자극 또한 세계 최초로 성공적으로 시연했다. 또한 체내 5주 이상 연속 구동이라는 세계 최고의 장기간 사용성을 기록했다.
열인발 공정은 공정 특성상 대량 생산과 제조 확장성에 유리해 상용화 관점에서도 장점을 갖는다. 향후 이 기술은 심박조율기, 신경자극기, 이식형 센서, BCI 등의 차세대 이식형 전자 장치와의 다양한 기술 협력으로 확장될 것으로 기대된다.
CABIN1 peptide effectively targets MEF2D-fusion protein in B-cell precursor acute lymphoblastic leukemia
Signal Transduction & Targeted Therapy

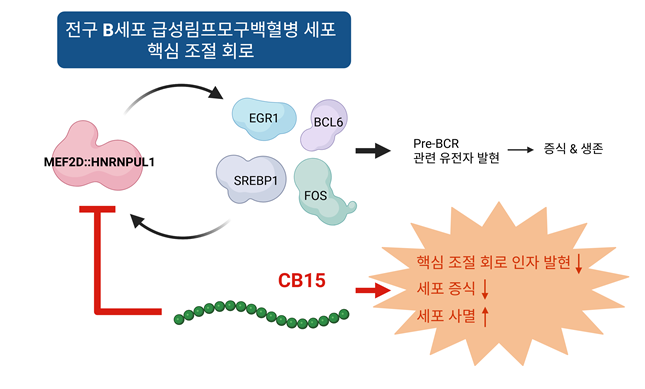
급성림프모구백혈병(acute lymphoblastic leukemia, ALL)은 소아암 가운데 약 30%를 차지하는 대표적인 난치성 질환이다. 이 중 약 80%를 차지하는 전구 B세포 급성림프모구백혈병(B cell precursor-ALL, BCP-ALL)은 환자의 상당수에서 염색체 재배열로 인해 키메라 융합 단백질이 생성되며, 이는 환자의 예후와 밀접한 관련이 있다. 특히 MEF2D 융합 단백질은 소아와 성인 환자 모두에서 발견되며, 매우 불량한 예후와 연관되어 있음이 확인되었다. 최근 연구에 따르면, 이 단백질들은 전구 B세포 급성림프모구백혈병 세포의 생존과 증식에 중요한 핵심 조절 회로(core regulatory circuit, CRC)의 중심 인자로 작용하는 것으로 보고되었다.
MEF2D는 N-말단에 위치한 MADS box와 MEF2 도메인을 가지고 있으며, 이들은 다른 단백질과의 상호작용 및 전사 활성 조절에 중요한 역할을 한다. 선행 연구에 따르면, CABIN1 (calcineurin binding protein 1)은 MEF2D의 MEF2 도메인에 결합하여 MEF2D의 기능을 억제하는 것으로 보고되었다.
연구진은 스크리닝을 통해 CABIN1의 C-말단 펩타이드(CB15, CABIN1 2156-2220)가 MEF2D 융합 단백질들과 강하게 결합하고, 이들의 전사활성을 효과적으로 억제할 수 있음을 확인하였다. 더불어, MEF2D-HNRNPUL1 융합 단백질(MEF2D::HNRNPUL1, MH)을 가진 전구 B세포 급성림프모구백혈병 세포주(KASUMI-7)에 CB15를 발현시킨 결과, 핵심 조절 회로 인자들의 세포 내 단백질 발현이 감소하였으며, 동시에 세포 증식이 급격하게 억제되고 백혈병 세포주의 90% 이상 사멸하는 것이 확인되었다.
기존의 백혈병 치료제는 T세포의 활성화를 활용하기 때문에 사이토카인 폭풍 증후군 등의 부작용이 발생할 수 있다. 반면, 본 연구의 CB15는 MEF2D 융합 단백질을 직접적으로 겨냥하여 T세포 활성화와 관련된 부작용을 피할 수 있다. 심각한 예후를 보이는 환자와 재발 환자를 위한 새로운 치료제가 요구되는 시점에서, CB15는 유망한 대안이 될 것으로 기대된다. 다만 본 연구는 치료 가능성을 보여주는 모델을 완성한 것이며, 이를 기반으로 차후 치료제 개발의 가능성을 기대할 수 있다.


Mouse tumor tissue-derived extracellular vesicles induce angiogenesis through VEGF production from macrophages
Journal of Extracellular Vesicles

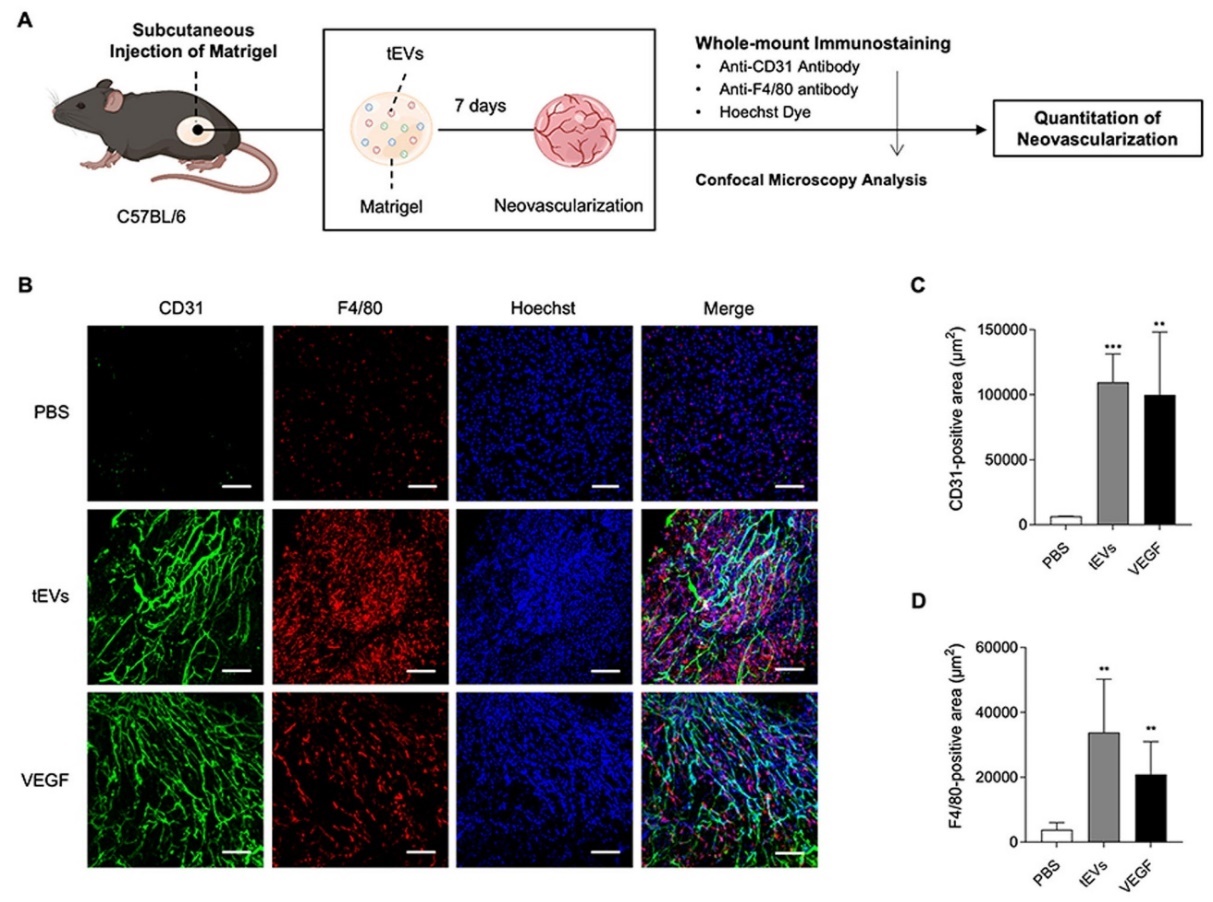
엑소좀(exosome, EV)은 세포가 분비하는 나노 크기의 지질 이중막 소포로 ‘세포 사이의 복합적인 정보 교환’에 핵심적인 역할을 한다. 기존의 연구들은 주로 시험관 내(in vitro) 세포 배양에서 유래한 EV를 사용했기 때문에 실제 종양 환경을 반영하는 데 한계가 있었다.
본 연구는 최초로 원발암 조직에서 직접 분리한 EV (tumor tissue-derived EV, tEV)를 이용하여 종양 미세환경에서의 실제 혈관신생(angiogenesis) 과정과 작용 기전을 규명하였다. 특히 tEV가 내피세포를 직접 자극하는 것이 아니라 대식세포를 유인하고 VEGF (vascular endothelial growth factor) 발현을 유도하여 혈관신생을 매개한다는 메커니즘을 제시함으로써, 종양관련 대식세포(tumor-associated macrophage, TAM)의 역할과 EV의 병리적 기능을 명확히 입증하였다.
종양 혈관신생은 암성장과 전이의 핵심 과정이며, 이를 차단하는 VEGF 억제제(anti-VEGF therapy)가 이미 임상에서 활용되고 있지만, 시간이 지나면 종양이 다른 경로를 통해 혈관신생을 유도하는 치료 내성과 고혈압, 상처 치유 지연 등의 부작용이 발생하는 한계가 있다. 본 연구는 기존 치료 전략의 한계를 보완할 수 있는 새로운 대식세포 - EV - VEGF axis를 제시하며 향후 EV를 활용한 종양 진단용 바이오마커 개발, EV-대식세포 상호작용 차단을 목표로 하는 신규 항암제 연구로 연결될 수 있다.
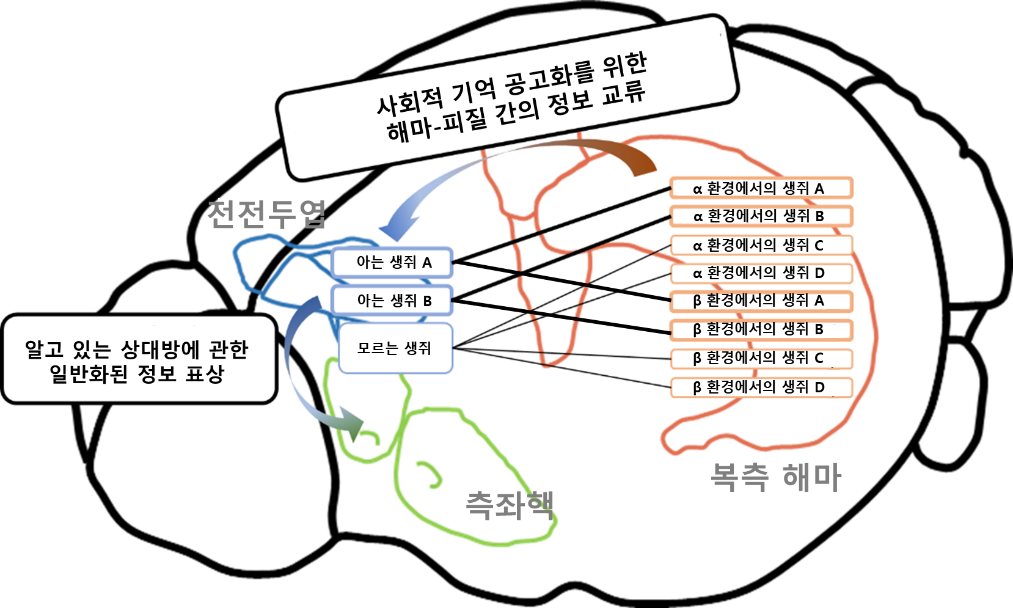
Hippocampal-cortical interactions in the consolidation of social memory
Nature Communications

(생리학교실, 교신저자)

(생리학교실, 제1저자)
사회적 대상에 대한 기억은 처음 형성될 때는 특정 장소나 환경과 함께 저장되지만, 시간이 지나면서 더 일반화된 형태로 변한다. 이를 설명하는 오래된 사례가 심리학자 조지 맨들러(George Mandler)가 제시했던 ‘버스에서 만난 정육점 사장님 현상(Butcher-on-the-bus phenomenon)’이다. 우리 동네 정육점 사장님을 가게에서 만났을 때는 쉽게 알아보지만, 버스나 길거리에서 마주치면 ‘내가 아는 사람인 것 같은데? 낯이 익다’라는 느낌은 들어도 곧바로 그 사람이 정육점 사장님임을 떠올리기 어려운 경험을 할 수 있다. 이는 기억이 처음에는 ‘A상가 정육점 주인’처럼 구체적 맥락과 연결되지만, 시간이 지나면서 단순히 ‘익숙한 사람’이라는 일반화된 형태로 변환되기 때문이다.
이용석 교수 연구팀은 사회적 기억이 저장되고, 친숙함으로 일반화되는 과정에 전전두엽–측좌핵 회로가 핵심적인 역할을 담당하며, 이때 해마로부터의 신호 입력이 필요하다는 점을 밝혀냈다. 연구팀은 생쥐에서 다양한 신경회로 조절기술과, 초소형 형광현미경(miniscope)을 이용한 실시간 뇌 활동 기록 기술 등을 활용해 이를 확인하였다. 연구 결과, 뇌측전전두엽 하부피질(medial prefrontal infralimbic cortex, IL)에서 측좌핵(nucleus accumbens shell, NAcSh)으로 이어지는 회로가 사회적 기억이 장기적으로 저장되는 핵심 경로임을 규명했다. 특히 이 회로는 개별 인물에 대한 정보가 시간이 지나며 ‘친숙함(familiarity)’이라는 일반화된 형태로 전환되는 과정을 담당하는 것으로 나타났다.
이번 연구는 사회적 기억이 단순히 해마에 의존하는 것이 아니라, 해마 신호를 바탕으로 전전두엽–측좌핵 회로에서 장기적이고 일반화된 형태로 공고화된다는 새로운 패러다임을 제시했다. 이는 자폐증, 조현병 등 사회적 인지 장애를 이해하는 데 새로운 단서를 제공할 뿐 아니라, 해당 회로를 기반으로 한 치료 전략 개발에도 중요한 가능성을 열어줄 것으로 기대된다.
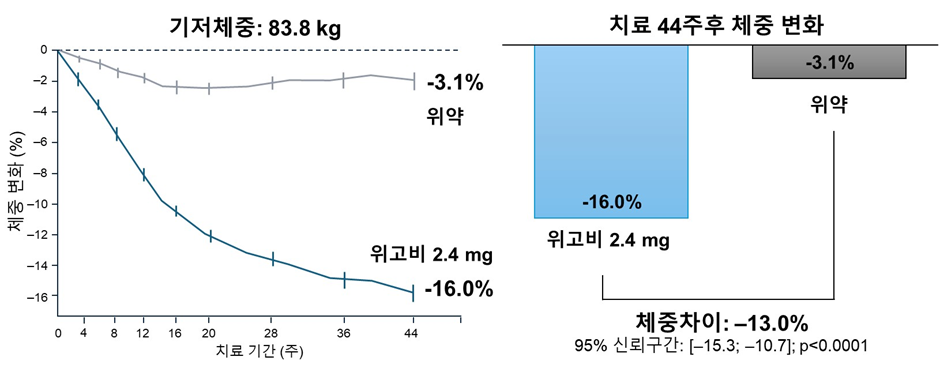
Once-weekly semaglutide 2·4 mg in an Asian population with obesity, defined as BMI ≥25 kg/m2, in South Korea and Thailand (STEP 11): a randomised, double-blind, placebo-controlled, phase 3 trial
Lancet Diabetes & Endocrinology

(내과학교실, 제1저자/교신저자)
서울대학교 의과대학 내과학교실 임수 교수가 총괄한 본 연구는 비만 치료제 세마글루티드(semaglutide, 제품명 위고비)의 동아시아 3상 임상시험 결과를 발표한 연구이다. 한국과 태국 12개 기관이 참여한 국제 공동 임상시험으로, 비당뇨 성인 비만 환자 150명을 대상으로 진행됐다. 연구진은 주 1회 세마글루티드 2.4mg 주사가 체중 및 복부 비만 개선에 미치는 효과와 안전성을 평가했다.
이번 연구의 특징은 동아시아에서 사용하는 체질량지수(BMI) 25kg/㎡ 이상을 비만 기준으로 적용했다는 점이다. 기존 서양 기준(BMI 27~30 이상)을 따른 연구는 국내 현실에 적용하기 어려웠으나, 이번 시험은 실제 임상 현장에 맞춘 근거를 제시했다.
44주간 치료 결과, 세마글루티드 투여군은 평균 체중이 16% 감소했고 허리둘레는 11.9cm 줄었다. 특히 15% 이상 체중 감량에 성공한 비율은 투여군이 53%, 위약군은 4.2%에 불과했다. 안전성 평가에서는 투여군의 89.1%에서 메스꺼움, 변비, 설사 등 위장관 증상이 보고됐으나, 위약군에서도 77.6%에서 이상반응이 보고되었으며 대부분 경미한 수준이었다. 이에 대해 연구진은 기존 GLP-1 계열 약물과 유사한 범위라고 설명했다.
이번 연구는 동아시아 비만 기준을 적용한 최초의 무작위 대조 임상시험으로, 한국인 비만 환자에서도 세마글루티드의 효과와 안전성을 확인했다. 향후 진료 지침과 보험 정책 마련에 중요한 근거가 될 것으로 보인다.
| 항목 | 세마글루티드 2.4mg 투약군 | 위약군 | |
|---|---|---|---|
| 체중 | -16% | -3.1% | |
| 허리둘레 | -11.9cm | -3.1cm | |
| 체중 감량 성공률 | 5% 이상 감량 | 96.0% | 25.0% |
| 10% 이상 감량 | 78.0% | 10.4% | |
| 15% 이상 감량 | 53.0% | 4.2% | |
| *측정 시점 : 임상시험 44주차 | |||
SCAMP5 regulates AP-4-dependent sorting and trafficking of ATG9A for presynaptic autophagy via PI4KB/PI4KIIIβ recruitment and PtdInsP4 production at the TGN
Autophagy

(생리학교실, 공동교신저자)

(의과학과, 공동제1저자)

(의과학과, 공동제1저자)
알츠하이머병과 파킨슨병 같은 신경 퇴행성 뇌 질환은 현재 인류가 가장 집중적으로 연구하는 의학 분야 중 하나다. 2016년 노벨생리의학상을 수상하며 큰 관심을 받았던 ‘자가포식(autophagy)’은 이러한 뇌 질환과 밀접한 관련이 있다고 밝혀지며 관련 기작을 밝히려는 많은 과학자들의 관심이 집중되고 있다. 하지만 여전히 뇌 속 신경세포, 특히 신호를 보내는 출발점인 시냅스전세포에서 자가포식이 어떻게 유발되는지 구체적인 분류 및 전달 기전은 여전히 풀리지 않는 수수께끼로 남아있다.
서울대학교 의과대학 장성호 교수 연구팀(공동 제1저자: 류승현 석사후연구원, 이정민 박사과정생)은 이 질문에 새로운 단서를 제시했다. 해당 연구팀은 시냅스전세포에서 자가포식을 일으키는 핵심 단백질인 ATG9A가 제 위치를 찾도록 돕는 중요한 조력자가 SCAMP5 단백질이라는 사실을 밝혔다.
연구 결과에 따르면, SCAMP5 단백질은 PI4KB 단백질과 결합해 세포 내 단백질 및 지질 분류센터로 알려진 트랜스골지체로 이동한다. 이 과정에서 세포 신호전달에 필수적인 PtdIns4P이 생성되며, 생성된 PtdIns4P로 모집된 AP-4 단백질은 ATG9A 단백질의 시냅스전세포로의 정확한 이동에 큰 영향을 끼치게 된다. 만약 SCAMP5 단백질이 사라질 경우, 이 정교한 시스템이 모두 무너져 시냅스전세포에서의 자가포식 현상이 제대로 일어나지 않고 오래된 단백질이 세포 안에 쌓이게 돼 결국 신경세포 손상과 사멸까지 이어질 수 있다.
이번에 밝혀진 기전을 통해 시냅스전세포에서 단백질 항상성이 어떻게 유지되는지를 보다 명확하게 이해할 수 있게 됐으며, 이는 앞으로 신경 퇴행성 뇌 질환과 자가포식 현상의 연관성을 규명하는 데 중요한 발판이 될 것이다.
해당 연구 결과는 세포생물학 분야의 권위 있는 학술지 ‘Autophagy’에 2025년 9월 16일 자로 실렸다.