[연구동향]
AI-generated MLH1 small binder improves prime editing efficiency
Cell

(생화학교실, 교신저자)

(유전체의학연구소, 공동제1저자)

(유전체의학연구소, 공동제1저자)
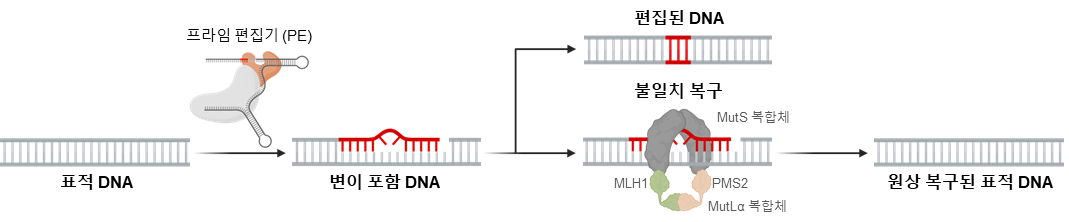
유전자 치료제 개발을 위한 차세대 기술로 주목받는 프라임교정(prime editing, PE) 기술은 DNA에 단일가닥 절단을 유도하는 nickase Cas9 단백질과 역전사효소를 결합해 원하는 위치의 DNA를 정밀하게 고치는 기술로, 기존 크리스퍼 유전자가위보다 더 정확하고 안전하게 유전 정보를 교정할 수 있는 기술이다. 하지만 프라임교정 효율은 세포 내 DNA 불일치 복구기작(mismatch repair, MMR)에 의해 방해받아 효율이 크게 낮아지는 문제가 있다(그림 1).
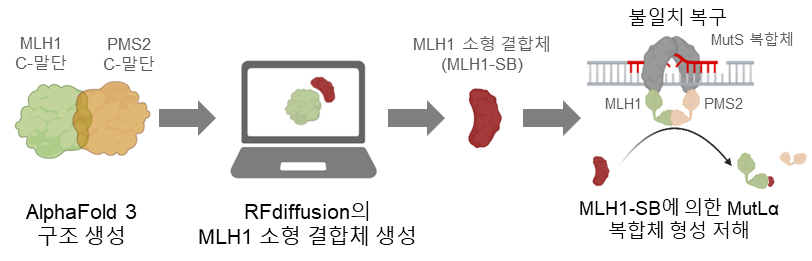
이를 해결하기 위해 본 연구진은 AI 기반 단백질 생성 기술인 로제타폴드 디퓨전(RFdiffusion)과 단백질 구조 예측 기술인 알파폴드 3(AlphaFold 3)를 활용해, 세포 내 DNA 불일치 복구기작을 저해하는 단백질을 설계하고자 했다. 즉, 세포 내 DNA 불일치 복구기작의 핵심 요소인 MLH1과 PMS2가 서로 결합하지 못하도록 막는 초소형 MLH1 결합 단백질(MLH1 small binder, MLH1-SB)을 만들어 냈다(그림 2). 최종 선별된 MLH1-SB는 단 82개의 아미노산으로 구성되어 크기가 매우 작아 향후 유전자 치료제 전달에 유리한 구조적 이점을 제공한다.
이번에 개발된 PE-SB기술은 기존 기술인 PE2와 비교해서 평균 18.8배, 최신 버전인 PE7과 비교해서는 약 2.5배 향상된 수치였다. 또한 연구진들은 생쥐 간에서도 프라임교정 효율이 약 3.4배 향상되었음을 보였다. 이 연구는 생성형 인공지능(AI) 기반 단백질 생성이 실제 생명과학 문제 해결에 적용 가능함을 보여주는 대표적인 사례로, 향후 정밀 유전자 치료 및 차세대 생명공학 기술 개발에 중요한 전환점이 될 것으로 기대된다.
본 연구는 세계 3대 과학저널 중 하나인 셀(Cell) 지에 8월 6일(한국시간) 온라인 출판되었다.
GluN2B suppression restores phenylalanine-induced neuroplasticity and cognition impairments in a mouse model of phenylketonuria
Journal of Clinical Investigation

(생리학교실/의과학과,
교신저자)

(생리학교실/SNU의생명과학단,
제1저자)
페닐케톤뇨증(phenylketonuria, PKU)은 페닐알라닌을 분해하는 효소의 결핍 또는 기능저하로 체내에 페닐알라닌이 축적되는 선천성 대사이상 질환이다. 조기에 진단과 중재를 하지 않으면 IQ 50 미만의 심각한 지능장애가 유발된다. 페닐케톤뇨증은 신생아 선별검사에 포함될 정도로 널리 알려진 질환이지만, 페닐알라닌 대사 이상이 인지 장애를 유발하는 기전에 대해서는 알려져 있지 않다. 이로 인해 페닐알라닌 섭취를 제한하는 식이요법이 치료법으로 활용되고 있다.
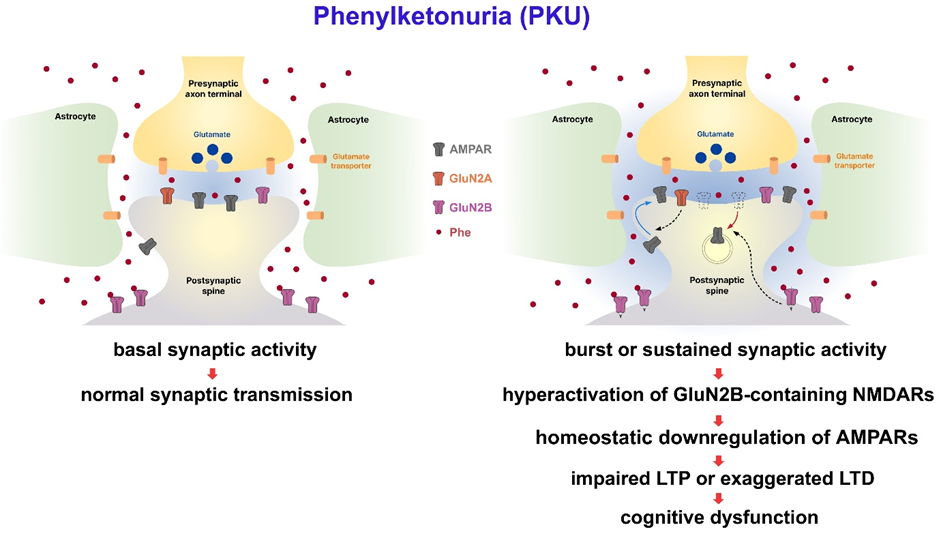
본 연구에서는 페닐케톤뇨증 질환모델(PahEnu2) 마우스와 정상 마우스를 활용한 페닐케톤뇨증 모델링을 통해 축적된 페닐알라닌이 뇌 기능을 교란하는 신경생리학적 기전을 연구하였다. 혈액에 축적된 페닐알라닌은 혈액-뇌 장벽(blood-brain barrier)을 지나 뇌척수로 전달되기 때문에 페닐케톤뇨증 마우스의 혈액과 뇌척수액에 존재하는 페닐알라닌의 농도는 큰 차이가 있었다. 다양한 농도의 페닐알라닌은 synaptic site에 위치하는 NMDA 수용체에는 영향을 주지 않았으나, 시냅스 외부(extra-synaptic site)에 존재하는 GluN2B를 포함하는 NMDA 수용체(GluN2B-NMDAR)에는 농도에 따라 다른 효과를 가짐을 발견하였다. 페닐케톤뇨증 환자의 혈액에서 관찰되는 수준의 고농도의 페닐알라닌은 GluN2B-NMDAR의 활성을 억제하였으며, 뇌척수액에서 관찰되는 수준의 낮은 농도의 페닐알라닌은 GluN2B-NMDAR 기능을 항진함을 확인하였다. 폭발적이거나 지속적인 시냅스 활성(burst or sustained synaptic activity)동안 과도하게 항진된 GluN2B-NMDAR은 AMPA 수용체의 항상성 하향 조절(homeostatic down regulation)을 유도하고, 이를 통해 시냅스 장기 강화(LTP)를 억제하거나 과도한 시냅스 장기 저하(LTD)를 유도함을 확인하였다.
흥미롭게도 페닐케톤뇨증(PahEnu2) 마우스의 신경세포는 페닐알라닌이 없는 상태에서는 정상적인 시냅스 기능과 가소성을 보였으며, 정상 마우스도 주입을 통해 페닐알라닌 농도를 상승시키면 인지행동에 장애를 보였다. 이는 상승된 페닐알라닌에 장기간 노출에 의한 비정상적인 신경 발달이나 뇌손상이 아닌 중추신경계에 존재하는 페닐알라닌이 페닐케톤뇨증 인지장애의 원인임을 암시한다. 이러한 발견을 바탕으로 GluN2B를 억제하면 페닐알라닌에 의한 시냅스 가소성 교란이 억제되고, 또한 GluN2B 억제에 의해 페닐케톤뇨증 마우스의 인지 기능도 개선됨을 관찰하였다. 결론적으로 페닐케톤뇨증 환자의 뇌척수액에 존재하는 농도의 페닐알라닌은 GluN2B-NMDAR의 과도한 항진을 통해 시냅스 가소성을 교란하고 인지 장애를 유발함을 알 수 있었다.
이번 연구는 신경생리학적 기전 규명을 통해 페닐케톤뇨증 인지장애 치료 전략을 제시한 연구로, 질환의 생화학적 기전은 명확하지만 중추신경계 장애의 신경생리학적 기전은 알려지지 않은 다양한 선천성 대사이상 질환의 연구에 활용 가능할 것으로 기대된다.
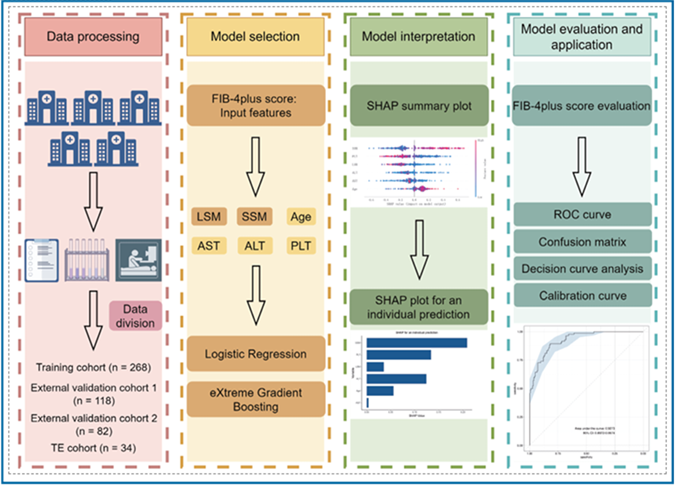
Fibrosis-4plus score: a novel machine learning-based tool for screening high-risk varices in compensated cirrhosis (CHESS2004): an international multicenter study
Clinical & Molecular Hepatology

위내시경 검사를 받는 환자의 대부분은 식도 정맥류가 없거나 작은 식도 정맥류만 가지고 있다. 본 연구에서는 대상 간경변증에서 고위험 식도 정맥류(HRV)를 식별하기 위해 섬유증-4(FIB-4) 점수, 간 경직도 측정(LSM), 비장 경직도 측정(SSM)을 결합하여 FIB-4plus라는 새로운 점수를 개발하기 위해 대규모 국제 다기관 코호트를 평가했다.
이 국제 코호트 연구는 17개의 다국가 3차 의료기관에서 대상 간경변증 환자를 포함했다. 2차원 전단파 탄성영상법으로 유도된 LSM 및 SSM 값과 FIB-4 점수의 구성 요소(나이, AST, ALT, 혈소판)를 기계 학습 알고리즘(로지스틱 회귀[LR] 및 극단 경량 부스팅[XGBoost])을 사용하여 결합하여 각각 LR-FIB-4plus 및 XGBoost-FIB-4plus 모델을 개발했다. 이후 Shapley Additive exPlanations 방법을 사용하여 모델 예측을 해석했다.
위내시경 검진을 받은 대상 간경변증 환자 502명의 데이터를 분석했다. XGBoost-FIB-4plus 점수는 HRV에 대한 우수한 예측 성능을 보여주었으며, 훈련 집단(n=268)에서 수신자 조작 특성 곡선 아래 면적(AUROC)은 0.927(95% CI 0.897–0.957)이었고, 첫 번째(n=118) 및 두 번째(n=82) 외부 검증 집단에서는 각각 0.919(95% CI 0.843–0.995)와 0.902(95% CI 0.820–0.984)였다. 또한, XGBoost-FIB-4plus 점수는 모든 코호트에서 식도 정맥류 예측을 위한 높은 AUROC 값을 나타냈다. FIB-4plus 점수가 개별 매개변수(LSM, SSM, PLT, FIB-4)를 능가했다.
FIB-4plus 점수는 대상 간경변증 환자에서 식도 정맥류와 HRV를 효과적으로 예측하여, 임상의들에게 환자 관리와 결과 최적화를 위한 귀중한 도구를 제공한다.
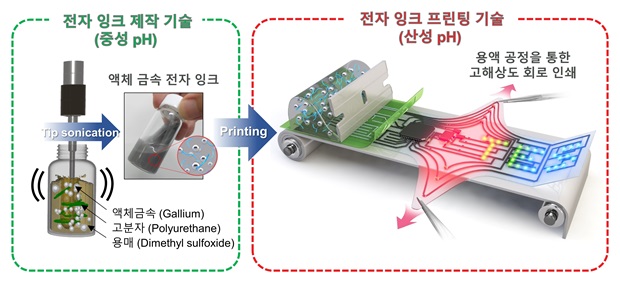
Phase-change metal ink with pH-controlled chemical sintering for versatile and scalable fabrication of variable stiffness electronics
Science Advances

서울대학교 첨단융합학부 및 의과대학 의과학과 소속 박성준 교수 연구팀은 KAIST 정재웅 교수(전기 및 전자공학부), 스티브박 교수(신소재공학과) 연구팀과 공동으로, 상온에서 인쇄 가능한 고해상도 액체금속 전자잉크(STiffness-Adjustable temperature-Responsive ink, STAR ink)를 개발, 이를 활용한 가변형 전자소자 및 바이오메디컬 인터페이스 기술을 세계 최초로 구현하였다.
기존 전자기기는 주로 단단한 구조로 제작되어 안정성은 높지만 착용성과 유연성은 떨어진다는 단점이 있다. 반면 최근에 개발되고 있는 유연성 기기는 편의성은 뛰어나지만, 정밀한 기능 구현에는 한계를 보인다. 이러한 상황에서 최근 웨어러블, 헬스케어, 신경 인터페이스 등에 사용될 수 있는, 환경에 따라 물성과 형태를 바꿀 수 있는 가변형 전자소자(TES)에 대한 관심이 높아지고 있지만, 이를 위한 핵심 소재로 주목받는 액체금속은 높은 표면장력과 불안정한 상변화로 인해 실제 적용에는 제약이 있었다.
본 연구에서 개발된 STAR ink는 마이크로 입자화된 갈륨(Ga)을 친수성 고분자(HPU) 매트릭스에 안정적으로 분산시키는 방법으로 만들어지며, 중성 조건에서는 고점도 잉크로서 고해상도 회로 인쇄가 가능하고, 인쇄 후 가열에 따라 산성 환경이 조성되며 입자 간 화학적 소결이 유도되는 공정을 통해 전기적 연속성과 기계적 일체성을 동시에 확보할 수 있다. 특히 이 공정은 기존 액체금속 회로 제작에서 요구되는 고온 열처리나 외부 기계적 압력을 사용하지 않아, 다양한 재료와 기하 구조에 손쉽게 적용할 수 있다.
해당 잉크로 제작된 STAR 기반 회로는 3차원 구조물에도 코팅이 가능하며, 유연하면서도 기계적으로 안정된 전기 인터페이스 구현이 가능하다. 본 기술은 기존의 갈륨 기반 TES에서 나타났던 높은 표면장력, 인쇄 해상도 저하, 불완전한 전도성 문제를 pH 기반 화학 소결이라는 새로운 접근으로 해결하였다.
연구진은 STAR ink의 응용 가능성을 검증하기 위해 두 가지 실제 장치를 구현하였다. 첫 번째는 고해상도 다층 인쇄회로기판(T-PCB)으로, 버튼 하나로 계산기와 생체신호 측정기기(PPG 센서) 기능을 전환할 수 있으며, 체온에 따라 딱딱한 상태에서 유연하게 변화하는 형태이다. 두 번째는 광유전학 자극과 신경신호 기록을 동시에 수행할 수 있는 이식형 뇌 신경 탐침으로, 삽입 시에는 딱딱한 형태를 유지하여 뇌 조직 손상을 줄이고, 삽입 후에는 체온에 의해 부드러워져 뇌 조직과의 장기 안정성을 확보할 수 있었다.
이번 연구는 액체금속 기반 회로의 주요 한계였던 인쇄 해상도, 공정 안정성 및 호환성 문제를 모두 해결함과 동시에, 일상생활에서 매우 유용할 것으로 예상되는 ‘디바이스의 기계적 물성 조절’이 가능함을 입증하였다. 이는 향후 본 연구로 개발된 잉크 및 이를 기반으로 한 디바이스가 인체 착용형 기기, 바이오메디컬 임플란트, 신경 재활 및 로보틱스 분야 등에서 광범위하게 응용될 수 있다는 것을 의미한다.
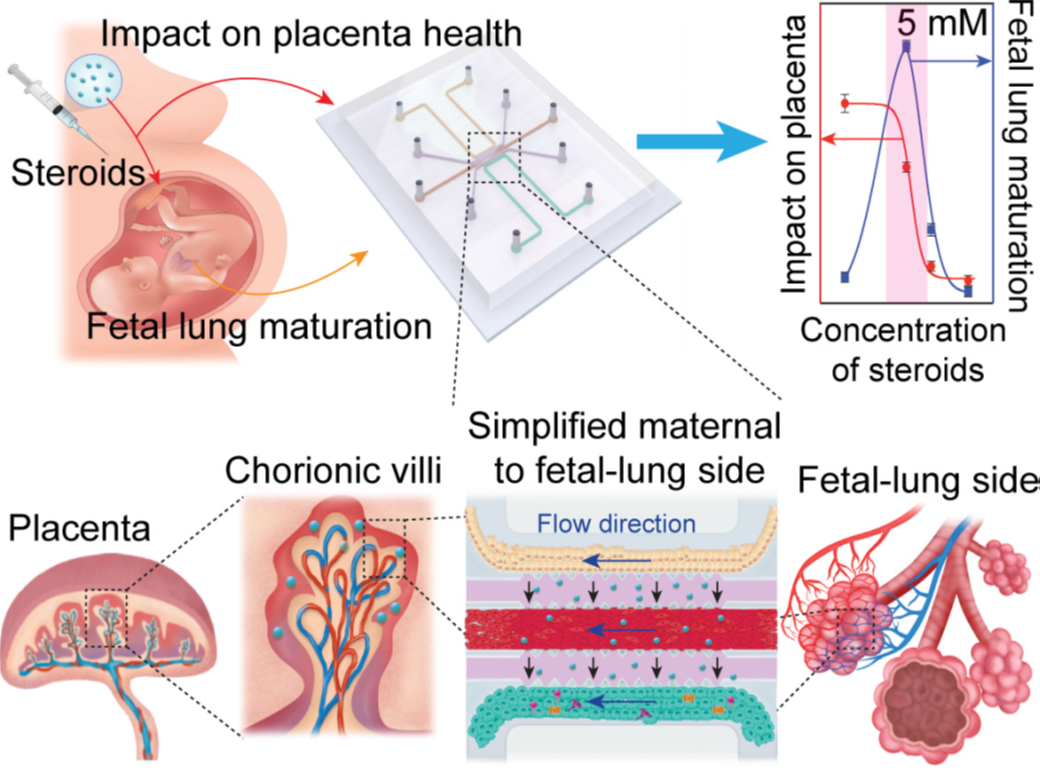
Understanding the impact of antenatal corticosteroids via placenta and fetal lung microphysiological analysis platform (MAP) on a chip
Trends in Biotechnology

(산부인과학교실, 공동교신저자)

(인구의학연구소, 공동제1저자)
산전 스테로이드 투여는 조산이 예상되는 경우 태아 폐성숙을 목적으로 사용되고 있으나 정확한 기전과 적정 용량에 대하여 알려진 바가 없다. 이에 본 연구에서는 태반-태아 폐 장기칩(placenta-fetal lung organ chip)을 개발하여 스테로이드가 태반을 통과하여 태아 폐에 도달하였을 때의 효과에 대하여 실험하고자 하였다.
미세생리학 분석 플랫폼(microphysiological analysis platform, MAP)에 태반과 혈관, 태아 폐 세 가지 공간으로 구성하여 각각 세포를 배양하여 층을 구성한 후 여러 가지 농도의 베타메타손과 덱사메타손을 투여하면서 태반칩의 변화를 확인하고, 태아 폐칩에서 생성되는 계면활성제 농도를 측정하였다. 스테로이드의 농도가 증가함에 따라 태반칩을 넘어 태아 폐칩에서 생성되는 계면활성제의 농도는 증가하였지만, 특정 농도부터는 생성되는 계면활성제의 양에 변화가 없는 지점이 있었으며, 이 농도에서는 태반세포로 구성된 층의 손상이나 활동력 상실을 확인했다.
임산부에게 투여하는 약물이 태아에 미치는 영향을 확인하기 위한 임상시험은 윤리적으로도, 연구방법론적으로도 매우 어렵고 한계가 있다. 이에 대해 본 연구에서는 임신을 생리학적으로, 생물학적으로 미세생리학 분석 플랫폼에서 재현하는 것이 임신 중 약물이 모체 및 태아에게 미치는 영향을 모니터링하는 데 유용한 연구방법이 될 수 있다는 가능성을 제시한다.
본 연구는 2020년 산업기술혁신사업 3D 생체조직칩기반 신약개발 플랫폼구축사업 중 3D 생체조직칩 제품화기술개발사업에서 ‘3D 다중장기 미세환경 통합플랫폼 기반 질환모델 및 약물효능 평가 기술개발’ 과제에 선정되어 산업통상자원부의 지원을 받아 수행되었다.
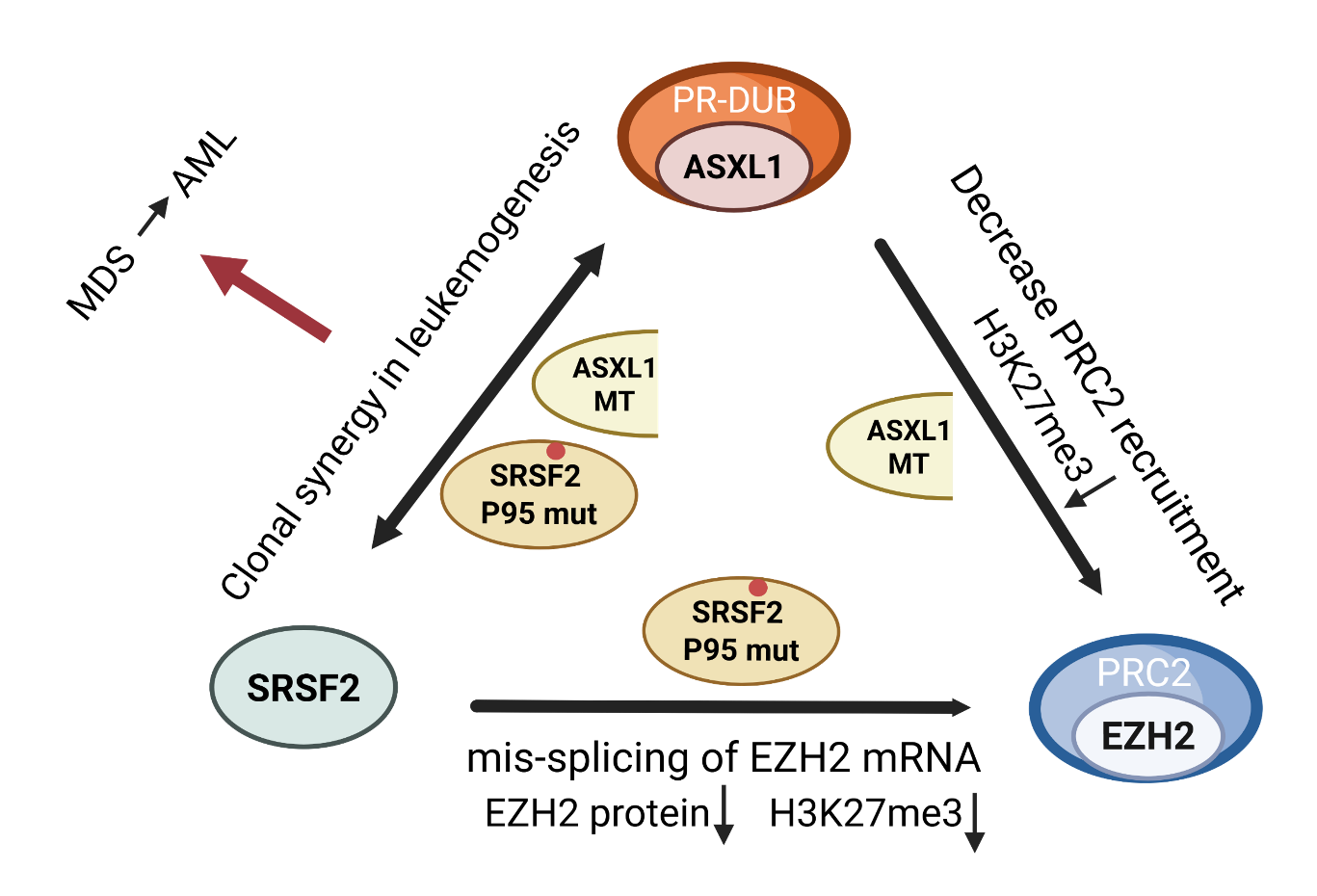
The role of ASXL1, SRSF2, and EZH2 mutations in chromatin dysregulation of myelodysplastic neoplasia and acute myeloid leukemia
Leukemia

(약리학교실/의과학과, 교신저자)

(의과학과, 제1저자)
골수형성이상증후군(myelodysplastic syndromes, MDS)과 급성골수백혈병(acute myeloid leukemia, AML)은 후성유전 조절에 관여하는 유전자 돌연변이가 자주 발견되는 대표적인 골수계열 혈액암이다. 그 중 ASXL1, SRSF2, EZH2 유전자는 환자에서 반복적으로 변이가 확인된 바 있으며, 예후가 좋지 않은 군에서 특히 높은 빈도로 관찰되어 왔다.
본 논문에서는 이 세 유전자의 돌연변이가 각각 어떤 기전을 통해 염색질 구조와 유전자 발현 조절에 영향을 미치는지를 정리하고, 서로 간의 기능적 연결 고리를 중심으로 병리적 상호작용을 통합적으로 분석했다. 특히 본 논문은 단순한 기초 생물학적 고찰을 넘어, 임상의로 활동 중인 혈액종양내과 교수님들과의 긴밀한 협업을 통해 임상적 의미와 치료적 관점까지 함께 조명하였다.
ASXL1 돌연변이는 PR-DUB 복합체의 기능을 약화시켜 H2AK119 ubiquitination 조절에 장애를 일으켰다. EZH2 돌연변이는 PRC2 복합체 활성을 감소시켜 H3K27me3 이질염색질 형성이 저해되는 현상을 보였다. SRSF2 돌연변이는 RNA 스플라이싱 선택성을 변화시켜 EZH2 등의 유전자 발현을 비정상적으로 만들었다. 이 세 유전자는 서로 영향을 주고받으면서 염색질 접근성과 전사 조절 네트워크에 광범위한 혼란을 초래하였고, 그 결과 악성 클론이 선택적으로 증식하기 유리한 환경이 형성되었다.
이번 리뷰를 통해 후성유전 조절 이상과 RNA 스플라이싱 오류가 단절된 현상이 아니라 하나의 연속적인 흐름 속에서 백혈병의 병태생리에 기여한다는 점을 정리하였다. 이러한 이해는 향후 위험군 분류나 치료 타겟 설정과 같은 임상적 의사결정에 도움이 될 수 있을 것으로 기대된다.
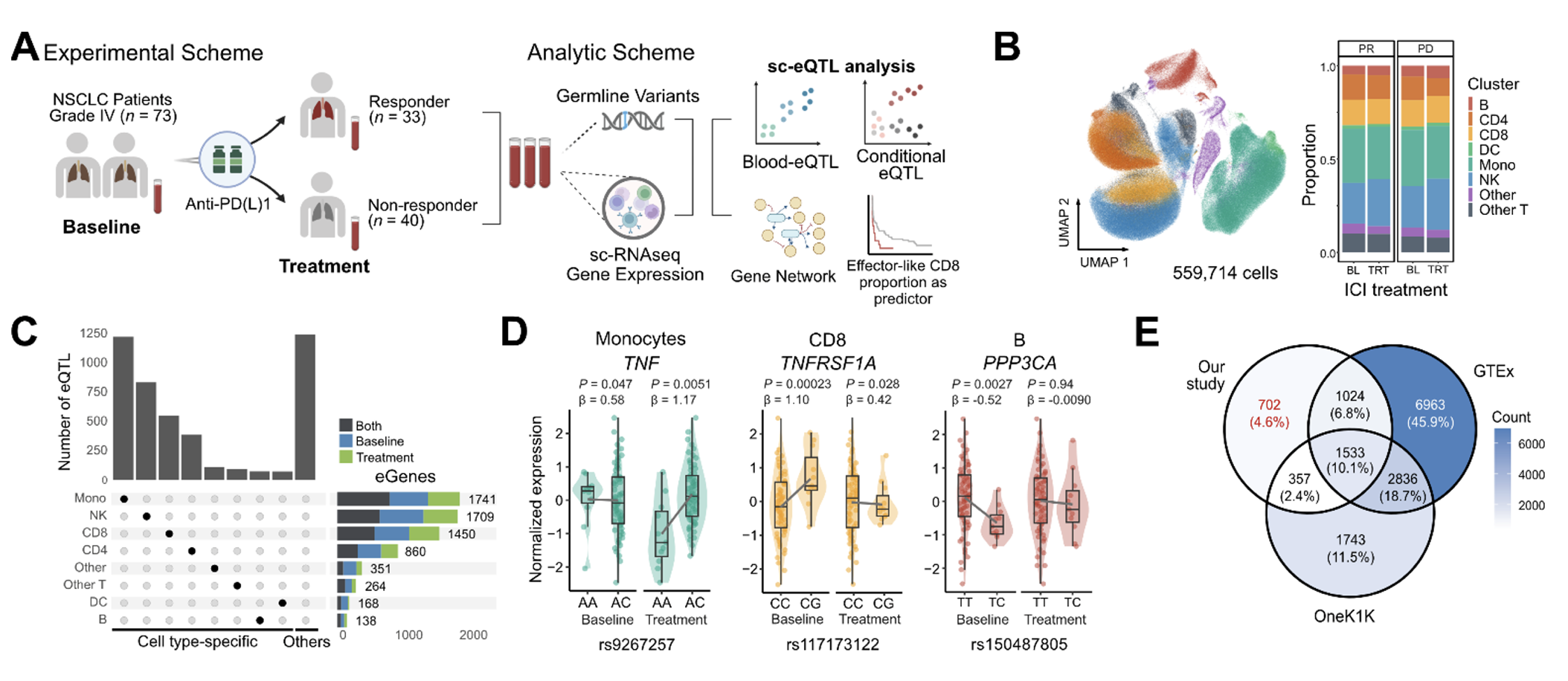
Single-cell-eQTL mapping in circulating immune cells reveals genetic regulation of response-associated networks in lung cancer immunotherapy
Cancer Communications

(의학과/의과학과, 공동교신저자)

(의과학과, 제1저자)
비소세포폐암(NSCLC) 환자에게 처방되는 면역항암제(ICI)는 이미 보편적 치료법으로 사용되고 있으나, 이에 대한 환자별 다양한 반응과 이를 예측하기 위한 관련 유전자 조절 네트워크는 아직 규명되지 않았기에 한계가 있었다. 이를 극복하기 위하여 서울대학교 의과대학 최무림 교수와 삼성서울병원 이세훈 교수 공동연구팀은 단일세포 RNA 시퀀싱(scRNA-seq)과 유전체 분석(SNP array)을 결합한 단일세포 eQTL 분석법을 통해 총 3,616개의 유전자-유전변이 연관관계를 밝혀냈다. 특히 CD8+ T 세포에서 관찰된 ‘CD8-brown’ 모듈이라는 유전자 집합이 면역치료에 반응하지 않는 환자들에서 현저히 높게 활성화되어 있음을 발견하였다. 이 모듈은 세포 독성 유전자(PRF1, GZMB 등)와 CD8+ T 세포 분화에 관여하는 전사인자(TBX21, EOMES)와 관련이 있으며, 치료 반응성과 생존율 예측에 중요한 역할을 한다는 사실을 입증하였다.
특히 이 연구는 ICI에 대한 반응성은 유전적으로 복합적인 형질로 다루어야 하며, 그렇기 때문에 단일 유전변이가 아닌 유전자 네트워크의 전반적 특성이 면역 반응을 조절한다는 점을 증명했다는 점에서 기존의 유전체 연구 방식과 차별된다. 향후 더 큰 규모의 환자군과 다양한 암종으로 연구를 확장해, 면역치료의 성공 가능성을 높이는 정밀한 예측 도구를 개발할 수 있을 것이다. 이 연구는 과학기술정보통신부·한국연구재단과 보건산업진흥원의 지원을 받아 수행되었다.
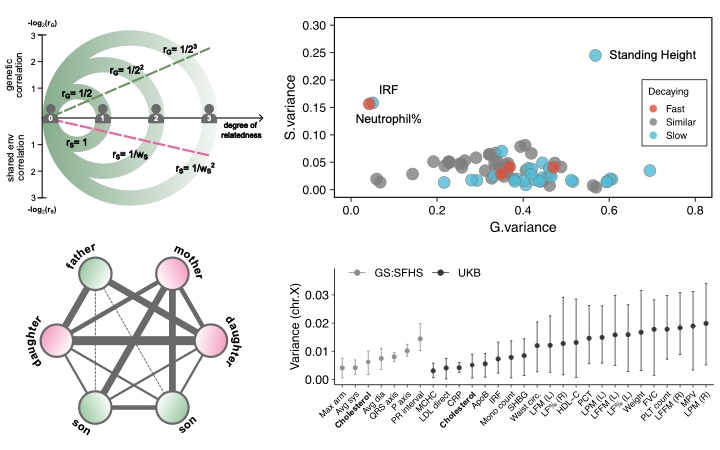
BIGFAM-variance components analysis from relatives without genotype
Nature Communications

(의과학과, 교신저자)

(바이오엔지니어링 협동과정,
제1저자)
의과대학 의과학과 한범 교수 연구팀은 유전자 분석 없이도 가족의 건강검진 기록만으로 신체 형질의 유전 기여도를 정밀 추정할 수 있는 분석 기법 ‘BIGFAM’을 개발하였다. 이 기술은 고가의 유전자 분석 없이도 대규모 유전 연구가 가능하다는 점에서 의의가 크다.
BIGFAM은 친족 간 유전적 유사성은 촌수가 멀수록 빠르게 감소하는 반면, 환경 유사성은 완만히 줄어드는 ‘감쇠 속도 차이’를 활용하고, 성별에 따른 X 염색체 유전 양상도 정교하게 반영한다. 이를 통해 유전 효과와 환경 효과를 수학적으로 분리할 수 있다.
영국 바이오뱅크 데이터를 통해 BIGFAM의 정확성이 검증되었으며, 키나 요산 수치 등 다양한 형질에서 기존 SNP 기반 분석과 높은 일치도를 보였다. 특히 키 형질의 최대 24.5%가 환경에 의해 설명되며, 요산 수치에서는 직계 가족 간 식습관이 주요 요인임이 밝혀졌다.
BIGFAM은 유전자 분석 없이도 정밀 유전 연구를 가능하게 해, 향후 의료 인프라가 부족한 지역에서도 폭넓은 활용이 기대된다.