[연구동향]
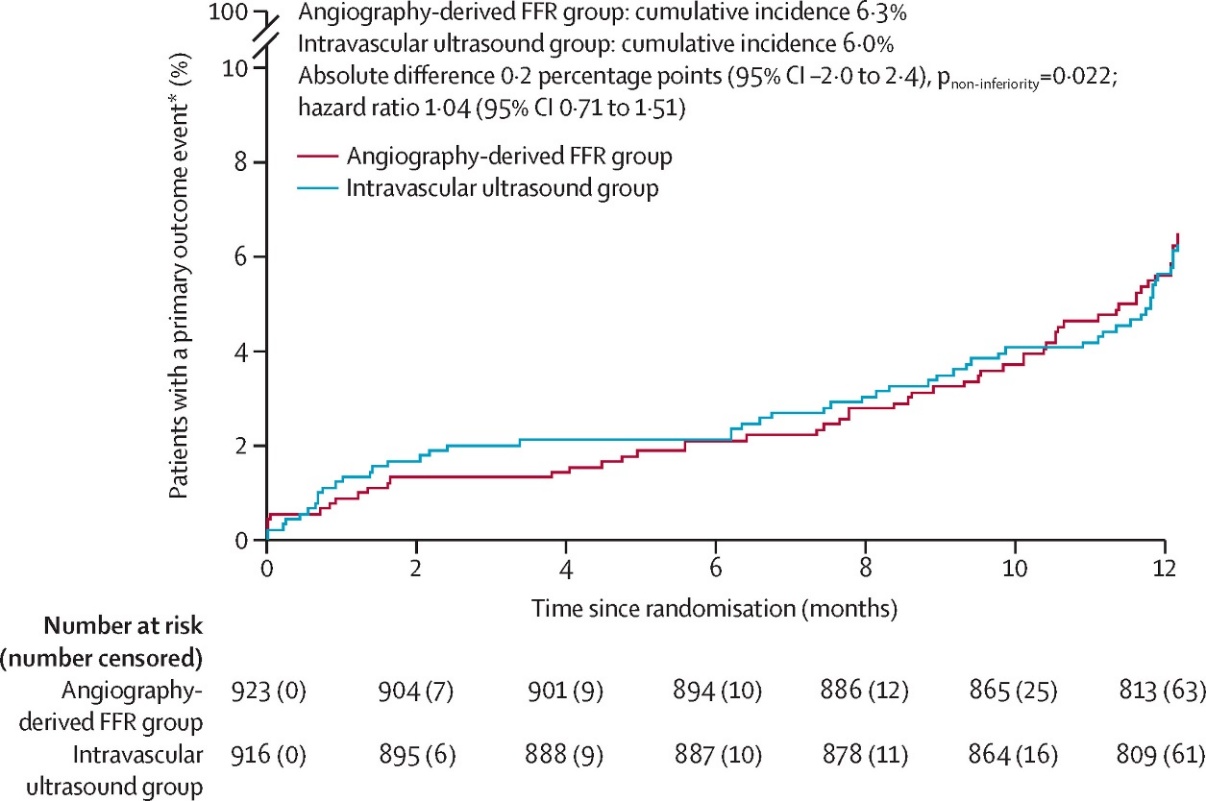
Angiography-derived fractional flow reserve versus intravascular ultrasound to guide percutaneous coronary intervention in patients with coronary artery disease (FLAVOUR II): a multicentre, randomised, non-inferiority trial
Lancet

관상동맥질환 치료에 있어 경피적 관상동맥중재술(PCI)은 병변의 중증도 판단과 스텐트 삽입 최적화를 필요로 한다. 기존에는 침습적 물리적 측정인 FFR과 혈관 내 초음파(IVUS)가 주로 활용되었지만, 혈관조영 유래(angiography-derived) FFR은 비침습적이고 간편하다는 장점으로 주목받고 있다. 이에 FLAVOUR II 연구에서는 중국 내 22개 병원에서 18세 이상의 협심증 의심 환자 1872명을 무작위로 배정하여 angiography-derived FFR 또는 IVUS를 기반으로 PCI 유도 및 최적화를 시행하였다.
12개월 간의 추적 결과, 주요 복합 심혈관 사건(사망, 심근경색, 재시술) 발생률은 angiography-derived FFR 군 6.3%, IVUS 군 6.0%로 비열등성이 통계적으로 입증되었다(비열등성 p=0.022). 두 군 간 사망률, 재협심증, 절차 관련 합병증 등에서도 유의한 차이는 없었다.
본 연구는 angiography-derived FFR이 보다 간편하고 비용 효율적인 대안임을 입증하였으며, 향후 PCI 가이드라인 내 광범위한 적용 가능성을 제시한 중요한 무작위 임상시험이다.
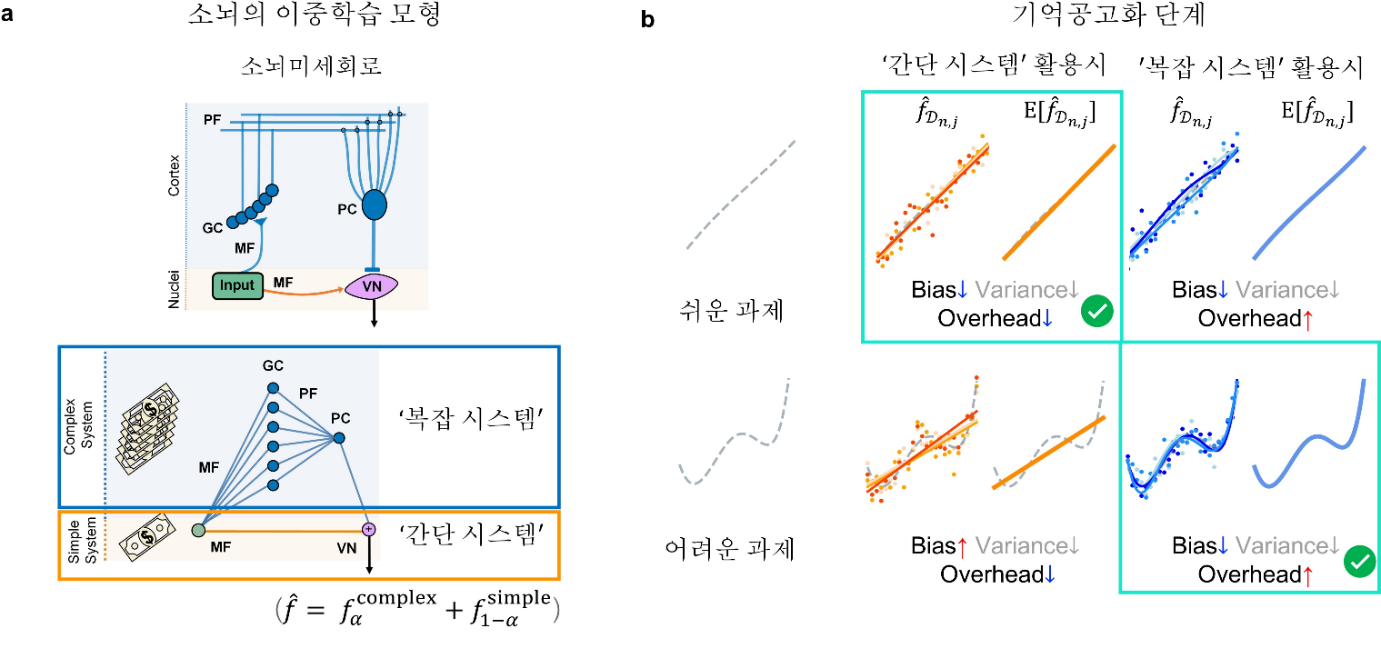
A normative principle governing memory transfer in cerebellar motor learning
Nature Communications

(생리학교실, 공동교신저자)

(의과학과, 공동제1저자)
소뇌는 운동 학습과 기억을 담당하는 핵심 뇌 영역으로, 복잡한 연산을 수행하지만 운영 오버헤드가 큰 ‘소뇌 피질’과, 계산은 단순하지만 비용이 적은 ‘소뇌 핵’으로 이루어져 있다. 전통적으로 운동 기억은 학습 초기에 소뇌 피질에서 형성된 뒤 시간이 지나면서 소뇌 핵으로 전달되어 장기 저장된다고 알려져 왔으나, 일부 기억은 완전히 전달되는 반면 다른 기억은 일부만 전달되거나 특정 요소만 선택적으로 저장되는 등 일관되지 않은 현상이 관찰되어 왔다.
서울대학교 의과대학 김상정 교수·가천대학교 한의대 김창업 교수팀은 ‘편향–분산 트레이드오프’ 이론을 소뇌의 이중 학습 시스템(복잡한 소뇌 피질 vs. 단순한 소뇌 핵)에 적용해, 뇌가 과제 난이도에 따라 두 시스템의 활용 비율을 조절해 전체 비용(편향+분산+운영 오버헤드)을 최소화한다는 사실을 밝혀냈다.
연구팀은 컴퓨터 시뮬레이션과 생쥐 실험을 통해 이 원리를 검증했다. 쉬운 과제(OKR 학습)는 시간 경과 후 소뇌 핵만으로도 학습이 유지되어 피질 억제 시에도 기억이 온전히 전달됨을 확인했다. 반면 어려운 과제(VOR 학습)는 소뇌 피질 억제 시 학습 효과가 크게 감소해, 피질 의존도가 여전히 높음을 보여주었다. 또한, VOR 증가 과제를 학습한 쥐는 훈련에 사용된 특정 자극 조건에서만 반응했고, OKR·VOR 감소 과제는 훈련하지 않은 조건에서도 일반화 현상을 보였다.
이 원리는 단순히 뇌 작동 메커니즘을 설명할 뿐 아니라, AI가 겪는 ‘평생 학습’과 ‘에너지 효율’ 문제 해결에도 시사점을 제공한다. 복잡 모듈과 단순 모듈을 ‘통합 비용 함수’ 하나로 실시간 제어하는 상위 원리는, AI 모듈형 설계에 적용할 수 있는 합리적 모델로 주목받는다.
본 연구는 AI의 학습 원리를 뇌과학에 접목해, 흩어져 있던 기억 저장 현상을 ‘과제 난이도’라는 하나의 통합 원리로 설명했으며, NeuroAI 접근을 통한 뇌와 AI의 상호 학습 가능성을 보여준다.
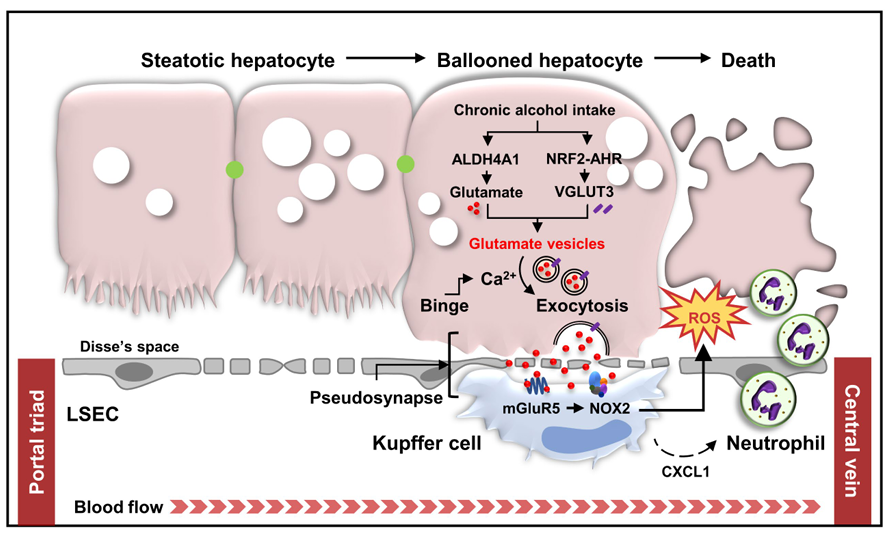
Binge drinking triggers VGLUT3-mediated glutamate secretion and subsequent hepatic inflammation by activating mGluR5/NOX2 in Kupffer cells
Nature Communications

글루타메이트는 간 아미노산 대사에서 중요한 역할을 하지만 면역 세포 활성화와 관련해서는 상대적으로 연구가 부족하다. 본 연구는 수컷 쥐를 대상으로 간 글루타메이트가 만성 알코올 섭취 시 아릴 탄화수소 수용체(AHR)에 의해 조절되는 소포성 글루타메이트 수송체 3(VGLUT3)을 통해 간정맥 주위 간세포의 소포에 축적된다는 것을 보여준다. 추가적인 폭음은 세포 내 Ca2+수치를 변화시켜 글루타메이트의 세포외 방출을 유도하고, 이는 대사성 글루타메이트 수용체 5(mGluR5)를 자극하여 쿠퍼 세포에서 NADPH 산화효소 2(NOX2)에 의해 활성 산소(ROS) 생성을 촉진한다. 이 간세포와 쿠퍼 세포 간의 상호작용은 알코올로 인한 간정맥 주위 간세포의 팽창으로 인해 발생하는 가상 시냅스 형성에 의해 촉진된다. 쿠퍼 세포에서 mGluR5 또는 NOX2의 유전적 또는 약리학적 간섭은 알코올 관련 지방간염을 완화한다. 환자 샘플 분석은 일부 쥐 실험 결과를 확인하며, 혈장 글루타메이트 농도와 VGLUT3 수준이 알코올 관련 지방간염 발달과 상관관계가 있음을 보여주었다. 결론적으로, 이번 연구 결과는 간세포와 쿠퍼 세포 사이의 유사 시냅스를 통해 알코올 관련 지방간염을 매개하는 글루타메이트 저장 및 방출의 중요성을 강조한다.
Self-packaged stretchable printed circuits with ligand-bound liquid metal particles in elastomer
Nature Communications

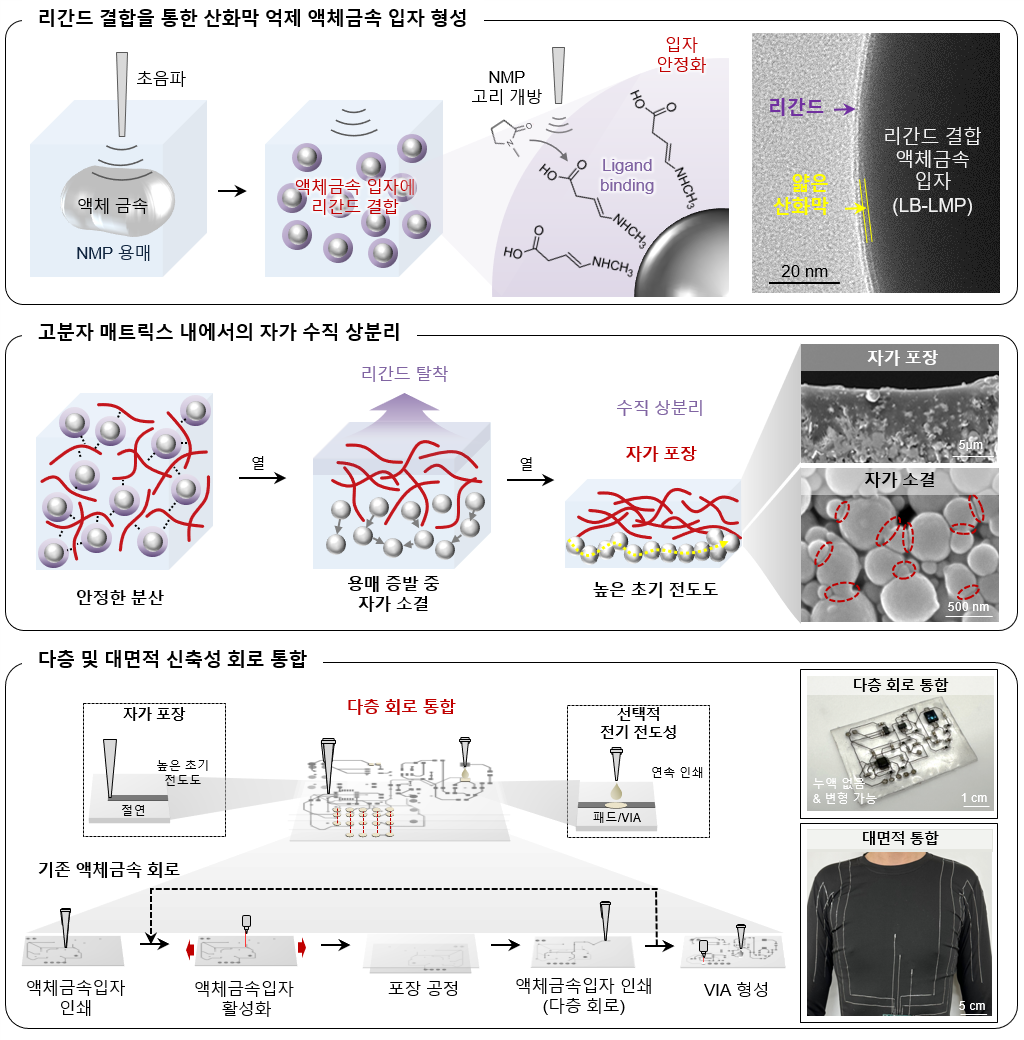
서울대학교 첨단융합학부/의과대학 의과학과 소속 박성준 교수 및 서울대학교 자연과학대학 화학부 강지형 교수 연구팀[서현엽 박사과정, 이건희 박사(현 부산대학교 교수)]은 인쇄 공정 중 도전성 형성과 절연 포장을 동시에 구현할 수 있는 신축성 회로 기술을 개발하였다. 본 기술은 리간드가 결합된 액체금속 입자(ligand-bound liquid metal particles, LB-LMPs)를 기반으로 하며, 별도의 활성화나 캡슐화 과정 없이 안정적인 신축성 전도체를 제작할 수 있다는 점에서 기존 회로 공정 대비 공정 간소화와 기능성을 동시에 달성했다는 평가를 받고 있다.
연구팀은 고온 조건에서 N-Methyl-2-pyrrolidone (NMP) 용매에 초음파를 가해 분자의 링-오프닝 반응을 유도하고, 생성된 아민계 리간드가 액체금속 입자 표면에 결합되도록 하였다. 이 리간드는 입자의 산화막 생성을 억제하고 분산 안정성을 높이며, 인쇄 후 용매가 증발하는 과정에서 자연스럽게 탈착되어 입자 간 자가 소결을 유도한다. 이와 동시에 입자들은 하부로 가라앉고 고분자는 상부에 형성되어, 별도의 공정 없이도 전도층과 절연 포장층이 동시에 구현되는 수직 상분리 구조가 완성된다.
이러한 구조를 기반으로 연구팀은 선택적 도전층 형성 기술도 구현하였다. LB-LMPs/고분자 복합체 위에 은 플레이크 기반의 고밀도 잉크를 도포하면, 상부 절연층을 뚫고 하부 전도층과 연결되는 수직 전기 통로가 형성된다. 이 방식은 원하는 영역에만 전기적 연결을 제공하며, 그 외 부분은 절연 상태를 유지해 회로 간 단락을 방지할 수 있다. 이를 통해 다층 회로와 수직 전기 연결(vertical interconnect access, VIA) 구조가 간단하게 구현되었으며, 회로 내 구성 요소와의 정밀한 전기 연결도 가능해졌다. 실제로 연구팀은 온도 센서 및 심박 측정(photoplethysmography, PPG) 기능이 통합된 다층 구조의 신축성 회로를 제작하고, 피부 부착 상태에서도 정확한 생체 신호 측정이 가능함을 확인하였다.
또한 연구팀은 PEDOT:PSS와 LB-LMPs를 조합한 전극(PEDOT:PSS/LB-LMPs electrode, PLE)을 제작해 웨어러블 및 바이오메디컬 인터페이스로도 확장하였다. 해당 전극은 신축성과 생체적합성을 동시에 갖추고 있으며, 실제 의류에 통합하여 근전도(electromyogram, EMG) 및 심전도(electrocardiogram, ECG) 측정을 수행한 결과, 일상적인 움직임에서도 안정적인 신호 수집이 가능함을 입증하였다. 나아가, 이 전극을 이용해 생쥐의 좌골신경을 자극하는 실험도 수행되었으며, 60 mV의 낮은 전압에서도 다리 움직임을 유도하는 등 신경 자극용 임플란트 전극으로서의 가능성도 확인되었다.
이번 기술은 신축성 회로에서 반복되는 복잡한 공정을 줄이고, 구조적 안정성과 기능성을 동시에 확보할 수 있는 새로운 접근으로, 향후 웨어러블 헬스케어, 스마트 의류, 신경자극기 등의 분야에서 다양하게 응용될 수 있을 것으로 기대된다.
Sustained oxygen-releasing hydrogel implants enhance flap regeneration by promoting mitochondrial biogenesis under mild hypoxia
Bioactive Materials

(성형외과학교실, 공동교신저자)

(성형외과학교실, 공동제1저자)
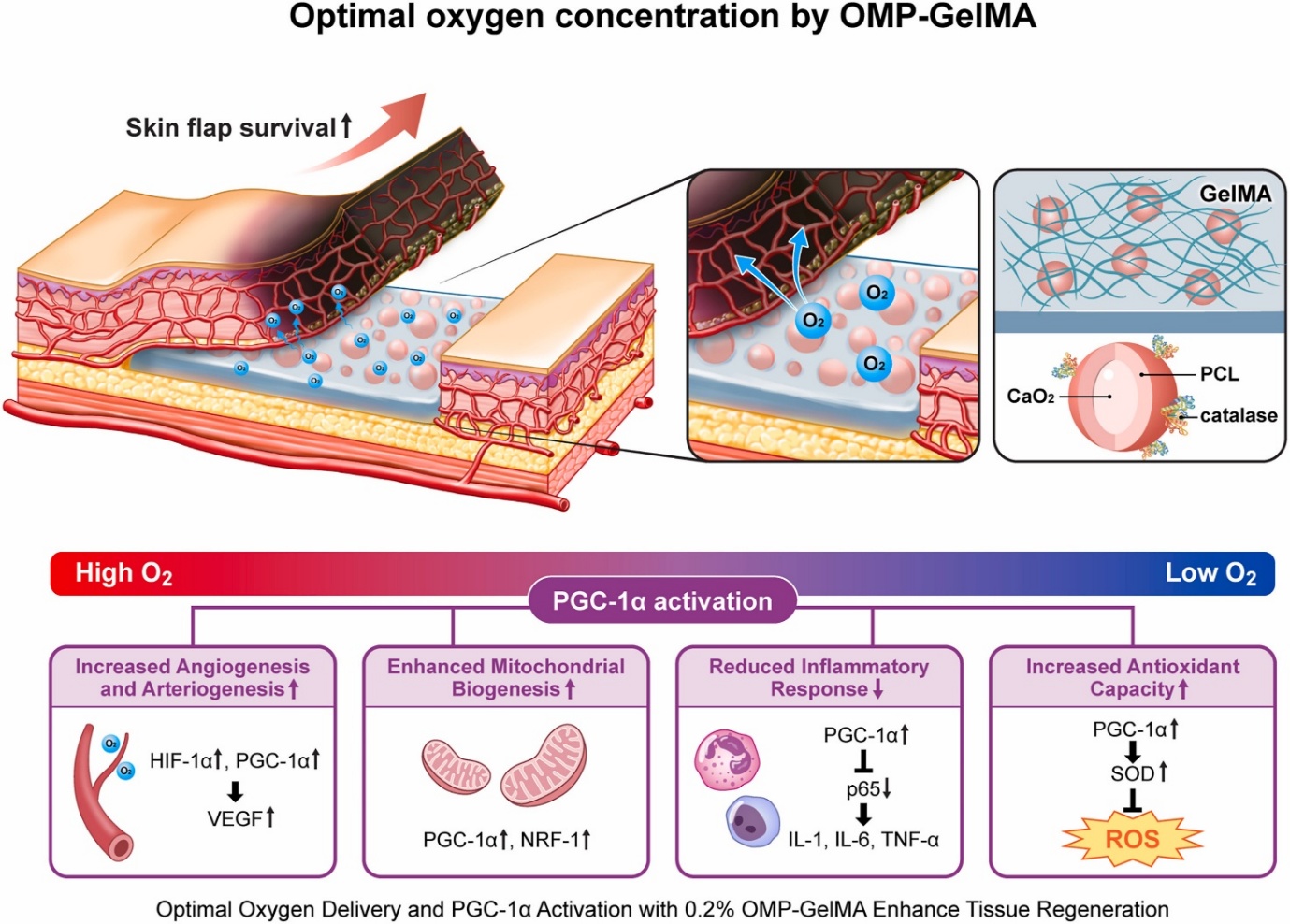
성형외과학교실 박지웅 교수 연구팀(전성미 교수, 이미현 연구원)과 하버드 의과대학 브리검여성병원 Su Ryon Shin 교수팀(정설하 박사)은 피판에서 발생하는 허혈성 조직 손상을 개선하기 위한 새로운 생체재료 기반 치료법을 개발하였다. 본 연구는 산소를 지속적으로 방출하는 산화칼슘 기반 미세입자(catalase-coated oxygen-generating microparticles, cOMP)를 젤라틴 메타크릴로일(GelMA) 하이드로겔에 포함시킨 복합체(cOMP-GelMA)를 제작하여, 조직 내 산소 공급을 조절하는 방식으로 재생을 유도한 것이다.
피부 피판은 외과 재건에서 널리 사용되지만, 피판 말단부의 혈류 저하로 인한 조직 괴사는 임상적 난제로 남아 있다. 기존 전신적 산소 치료는 산소의 과잉 노출로 인한 부작용, 경피전달 국소산소발생기는 투과 한계로 인해 사용범위나 효과가 제한적이었으며, 본 연구는 이러한 문제를 해결하기 위해 ‘적정 산소 농도’의 지속적이고 국소적인 공급이라는 새로운 접근을 제시했다. 특히, 0.2% 농도의 cOMP-GelMA는 조직재생에 적정한 산소농도를 유지하며 VEGF 및 HIF-1α를 통한 혈관신생, PGC-1α/NRF-1 경로를 통한 미토콘드리아 생합성, 항산화 효소(SOD) 유도 등을 통해 조직 회복을 유의하게 촉진했다.
연구팀은 실제 임상과 유사한 3×9 cm² 크기의 랫드 무작위 피판 모델을 활용하여 치료 효과를 입증하였으며, 0.2% 농도에서 피판 생존율과 혈류량이 가장 높게 유지되었다. 반면, 0.5% 농도에서는 산소 과잉에 따른 염증 반응 증가와 조직 손상이 관찰되어, 산소 농도의 정밀한 조절이 치료 효과에 핵심적임을 시사하였다.
이번 연구는 피하 국소산소공급 생체소재를 단순한 보조요소가 아닌 조직 미세환경 조절의 주요 수단으로 재정의하였으며, 피판 생존뿐만 아니라 염증 억제, 산화 스트레스 완화, 세포 대사 회복까지 통합적으로 개선하는 바이오소재로서의 가능성을 제시하였다. 향후 당뇨병성 궤양, 허혈성 근육질환 등 다양한 재생의학 응용으로의 확장이 기대된다.
A rational engineering strategy for structural dynamics modulation enables target specificity enhancement of the Cas9 nuclease
Nucleic Acids Research

본 연구는 서울의대 생화학교실 배상수 교수팀 및 서울대 화학부 김성근 교수팀(현 포스텍 총장), 연세의대 김형범 교수팀이 공동으로 수행한 연구로 단백질 동적 변화를 제어하는 전략으로 표적 정확도가 크게 향상된 크리스퍼 유전자가위(Correct-Cas9)를 개발한 연구이다.
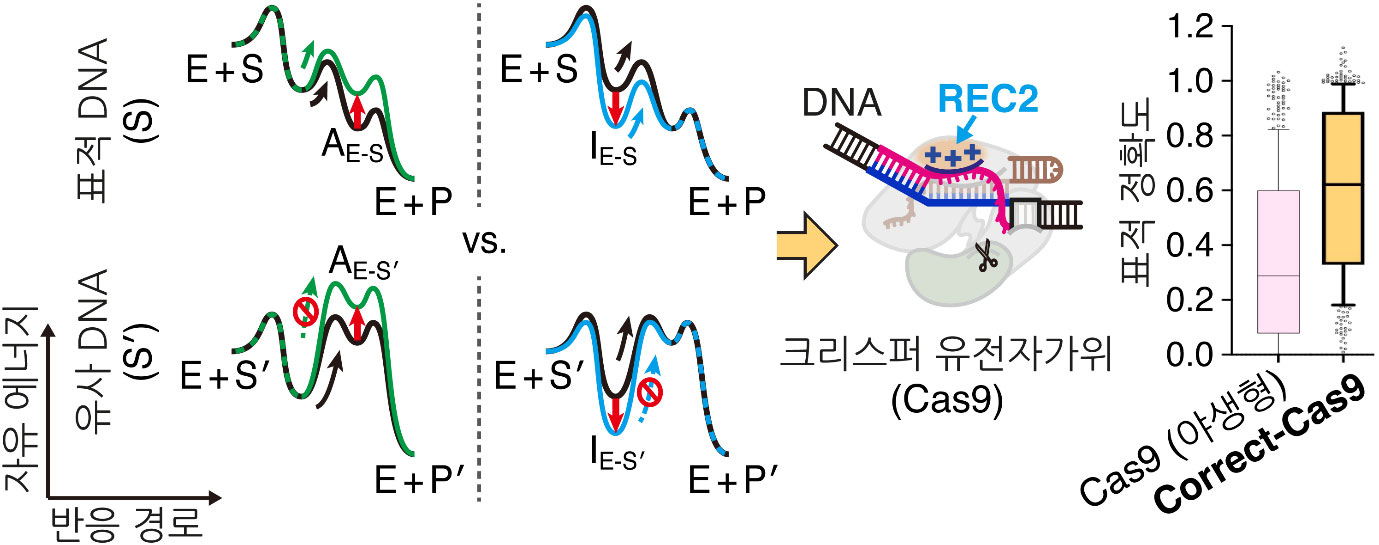
크리스퍼(CRISPR-Cas9) 유전자가위는 원하는 유전자의 DNA 염기서열을 선택적으로 잘라냄으로써 유전자를 교정할 수 있어, 암 및 난치성 유전 질환 치료를 위한 차세대 생명공학기술로 크게 주목받아 왔다. 하지만 자연 그대로의 크리스퍼 유전자가위는 표적으로 하는 DNA와 비슷한 염기서열을 지닌 유사 DNA까지도 자르는 낮은 정확도와 그로 인한 비표적 효과가 그 한계로 지적된다. 특히, 인간의 게놈은 약 30억 개의 DNA 염기로 구성되어 있기에, 그중에서 표적 염기서열 하나만을 정확히 골라 잘라낼 수 있는 표적 특이성은 크리스퍼 유전자가위를 활용한 유전자 치료 기술 개발에 있어 요구되는 필수 요소이다.
본 연구에서는 효소 단백질이 효소 반응을 일으키는 과정 동안 겪는 구조 변화 움직임을 동적으로 제어하는 새로운 전략의 합리적 설계(rational design) 단백질 공학 기법을 개발하였다. 본 연구진은 새롭게 고안한 동적 단백질 공학 기법을 활용하여 새로운 크리스퍼 유전자가위 변이체를 개발하였다. 더 나아가, 본 연구에서 개발한 변이체와 기존의 단백질 공학 기법으로 개발된 변이체와의 조합을 통해, 표적 정확도가 더욱 향상된 Correct-Cas9 크리스퍼 유전자가위를 개발해 내는 데에 성공하였다.
이러한 연구결과는 비표적 효과로부터 자유로운 크리스퍼 유전자가위 개발을 위한 새로운 발판이 될 것으로 기대되며, 염기교정 및 프라임교정 기술 등 크리스퍼 유전자가위에 기반한 최첨단 유전자 교정 기술의 표적 정확도를 높이는 데에도 활용될 수 있을 것으로 예상된다. 뿐만 아니라, 본 연구에서 개발한 새로운 동적 합리적 설계 기법은 크리스퍼 유전자가위 이외에도 다양한 효소 단백질의 특성 개선에 활용될 수 있을 것으로 기대된다.
본 연구는 생화학분야 국제 학술지인 핵산연구(Nucleic Acids Research)에 출판되었다.
Genome-scale knockout simulation and clustering analysis of drug-resistant breast cancer cells reveal drug sensitization targets
PNAS

유방암에서 항암화학요법은 암 치료에 있어 핵심적인 전략이지만, 치료 과정에서 나타나는 약제 내성의 획득은 여전히 극복하기 어려운 주요 난제이다. 특히, 약제 내성 암세포에서는 대사 재프로그래밍(metabolic reprogramming)이 특징적인 현상으로 나타나며, 이를 조절하는 새로운 치료 전략이 필요한 상황이다.
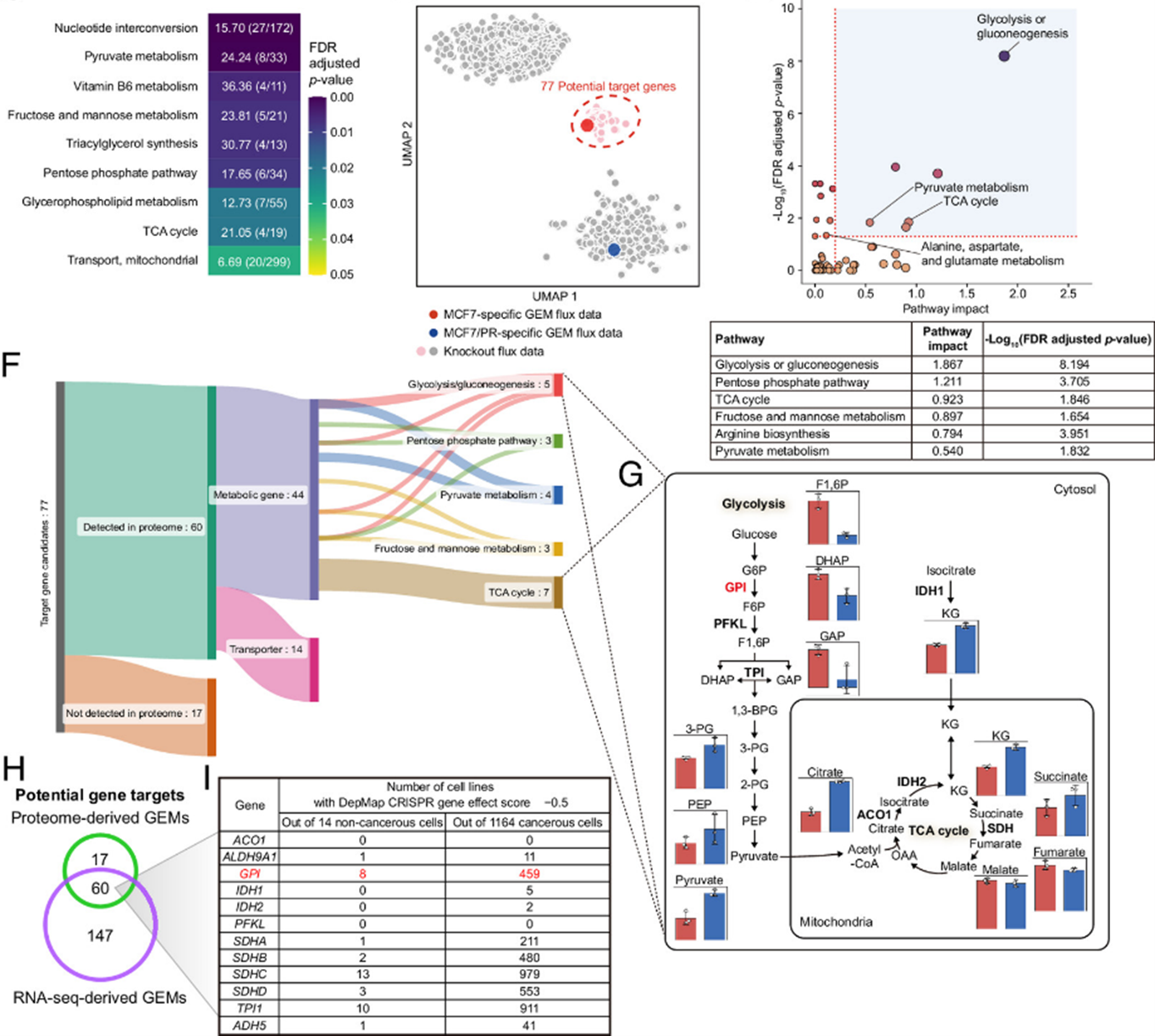
본 연구에서는 내성 암세포의 대사 상태를 민감한 모세포 상태로 되돌릴 수 있는 대사 유전자 타겟을 예측하는 계산 기반 프레임워크를 개발하였다. 개발된 프레임워크는 genome-scale metabolic model (GEM)을 기반으로 단일 유전자 결손 시뮬레이션(single-gene knockout simulation)을 수행하고, 그 결과로 생성된 전유전체 대사 플럭스 분포(flux profile)를 UMAP (uniform manifold approximation and projection) 및 k-means clustering 기법으로 클러스터링 분석하였다.
이러한 클러스터링 결과로부터, 민감한 모세포의 대사 상태와 유사한 클러스터에 속한 knockout 유전자들을 약제 감작 유전자 타겟(drug sensitization targets)으로 제안하였다. 그 결과 GOT1 (doxorubicin-resistant MCF7), GPI (paclitaxel-resistant MCF7), SLC1A5 (공통 타겟)이 도출되었으며, 이후 해당 유전자들을 타겟으로 하는 소분자 억제제를 처리한 실험에서도 내성 세포가 각각의 항암제에 대해 감작을 회복하는 것이 확인되어 계산 예측의 생물학적 유효성을 입증할 수 있었다. 또한, 본 프레임워크를 삼중음성유방암(triple-negative breast cancer, TNBC)의 내성 세포에도 적용한 결과, 항암제 반응도를 조절하는 효과를 확인함으로써 유방암 내 다른 분자 아형으로의 확장 가능성도 제시하였다.
종합적으로 본 연구는 암 대사 기반 내성 극복 전략을 위한 직관적이고 비용 효율적인 계산적 접근법을 제시하였으며, 향후 다양한 암종 및 대사 질환에서도 응용 가능한 플랫폼으로 활용될 수 있을 것으로 기대된다.
본 연구는 서울대학교 의과대학 병리학교실 유한석 교수와 공동 연구팀(KAIST 김유식 교수 및 KAIST 김현욱 교수)이 수행한 연구이다.
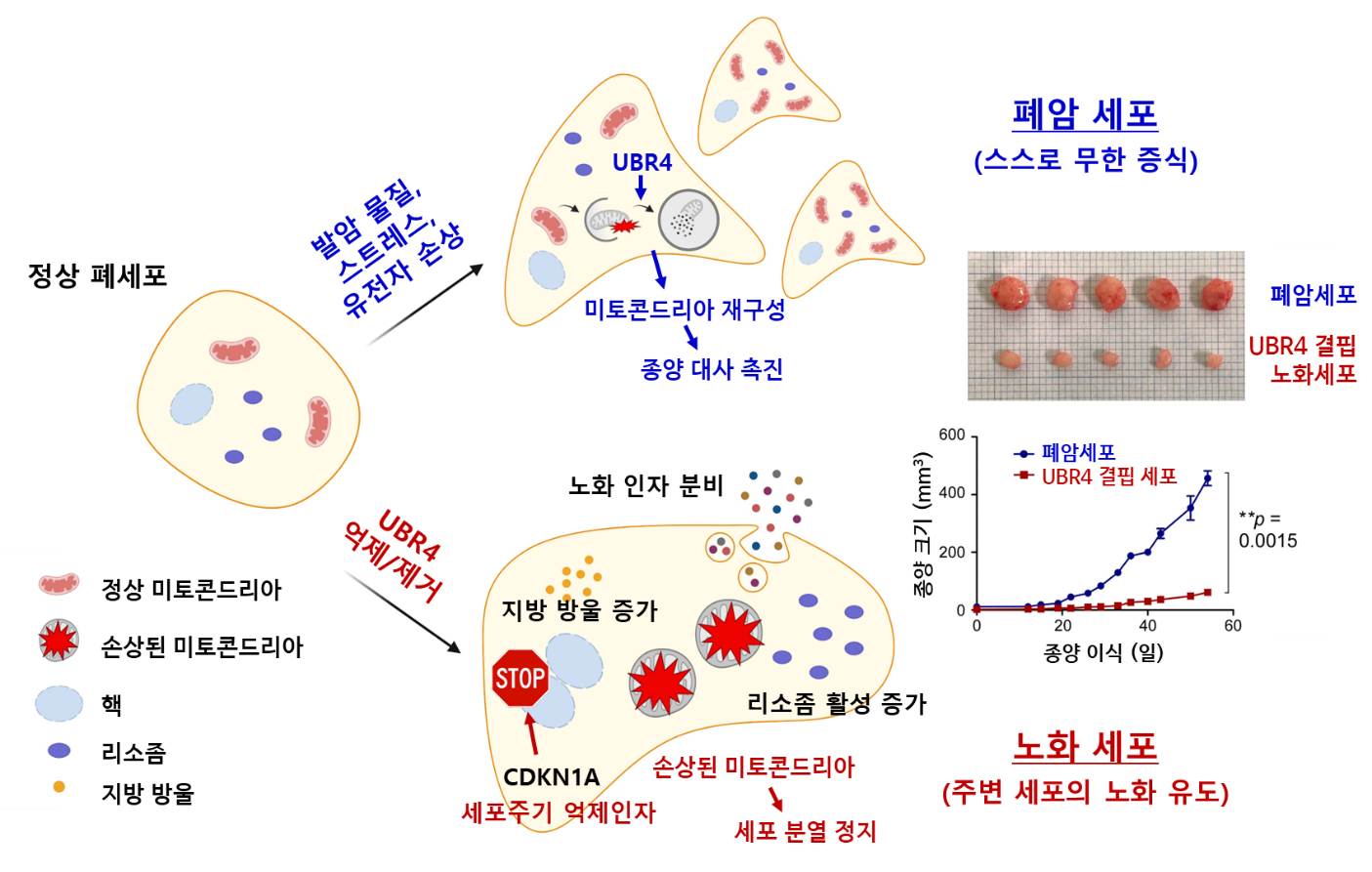
Tumor-promoting UBR4 coordinates impaired mitophagy–associated senescence and lung adenocarcinoma pathogenesis
PNAS

(생화학교실, 공동교신저자)

(의과학과, 공동제1저자)
서울대학교 기초의학교실 공동연구진은 UBR4가 정상 폐세포에서 미토콘드리아의 재구성과 에너지 대사를 활발하게 만들어 폐암 발생을 유도할 수 있다는 사실을 세계 최초로 규명하였다. 반대로 UBR4가 없으면 세포는 분열을 멈추고 노화 상태에 들어가는 것으로 나타났다. 즉 UBR4는 암 발생과 노화라는 세포의 완전히 서로 다른 운명을 결정하는 핵심 인자임을 발굴한 것이다. 이러한 연구 결과는 노화에 따라 암 발생 위험이 증가한다는 기존 이론을 한층 확장시킴을 의미한다. 세포는 미토콘드리아의 조절을 통해 유전자가 손상된 경우에도 무한 증식하는 암세포가 되는 대신 성장이 멈춘 노화 상태로 진입시키는 일종의 안전장치를 가지고 있다는 사실을 보여준다.
UBR4가 결핍되면 손상된 미토콘드리아를 제거하는 자식작용(오토파지, autophagy)이 제대로 작동하지 않아, 세포는 에너지 결핍, 산화 스트레스, 리소좀 기능 저하 상태로 빠져들게 된다. 이러한 변화가 종합적으로 세포를 노화로 이끌게 되며, 흥미롭게도 노화 인자를 분비하여 주변의 다른 세포들까지도 함께 노화시키는 것이 확인되었다.
마우스 모델 실험에서, UBR4를 제거한 후 이식한 폐암세포의 성장이 완전히 억제되는 것이 확인되었다. 또한 실제 폐선암 환자 조직을 분석한 결과, 암이 진행될수록 UBR4 단백질의 양이 점점 많아지는 경향도 관찰되어, 마우스 모델 실험과 폐선암 환자에게서 동일한 매커니즘이 작동함을 뒷받침하였다.
따라서 UBR4의 기능을 약물로 억제하거나 유전자 편집기술로 제거할 수 있다면, 기존 치료에 잘 반응하지 않는 난치성 폐암 환자에게 새로운 치료법을 제공할 수 있을 것으로 기대된다. 나아가, 미토콘드리아 기능 이상을 동반하는 다양한 암에도 폭넓게 활용될 가능성이 있다.
Cholinergic degeneration in isolated REM sleep behavior disorder (prodromal Lewy body disease)
Brain / Alzheimer’s & Dementia
-아래 내용은 루이소체질환의 전구단계를 주제로, 서로 다른 분석 관점에서 진행된 두 편의 논문을 함께 소개하는 형식으로 구성되어 있음-

(보라매병원 신경과, 교신저자)

(보라매병원 신경과, 제1저자)

(서울대학교병원 의생명연구소,
제1저자)
서울대학교병원운영 서울특별시보라매병원의 신경과/핵의학과 연구진은 파킨슨병으로 대표되는 루이소체질환의 임상적 증상이 발현되기 전 단계인 특발성 램수면행동장애 환자들에서 뇌아세틸콜린신경계의 위축이 언제부터 나타나 얼마나 빠른 속도로 진행하는지를 전향적 코호트 연구데이터를 통해 규명하였다. 이를 통해 루이소체질환의 조기 진단 및 예후를 판정하는 중요한 지표를 제시하였고, 또한 이 시기 아세틸콜린신경계 변성에 대한 치료적 개입이 필요함을 강조하였다.
루이소체질환(Lewy body disease)인 파킨슨병(Parkinson’s disease, PD)과 루이소체치매(Dementia with Lewy bodies, DLB)는 알츠하이머병 다음으로 흔한 신경퇴행성 뇌질환으로, 신경학적 이상증상이 발현되기까지 최장 10년 정도의 전구기를 갖는 것으로 알려져 있다. 이 전구단계의 루이소체질환을 상징하는 가장 확실한 임상적 마커는 특발성 램수면행동장애(REM sleep behavior disorder, RBD), 즉 다른 신경학적 이상 없이 특징적인 수면이상만 나타나는 단계인 isolated RBD (iRBD) 단계이다. 뇌 아세틸콜린신경계의 변성은 도파민신경세포의 소실과 함께 루이소체질환의 가장 큰 특징 중 하나이다.
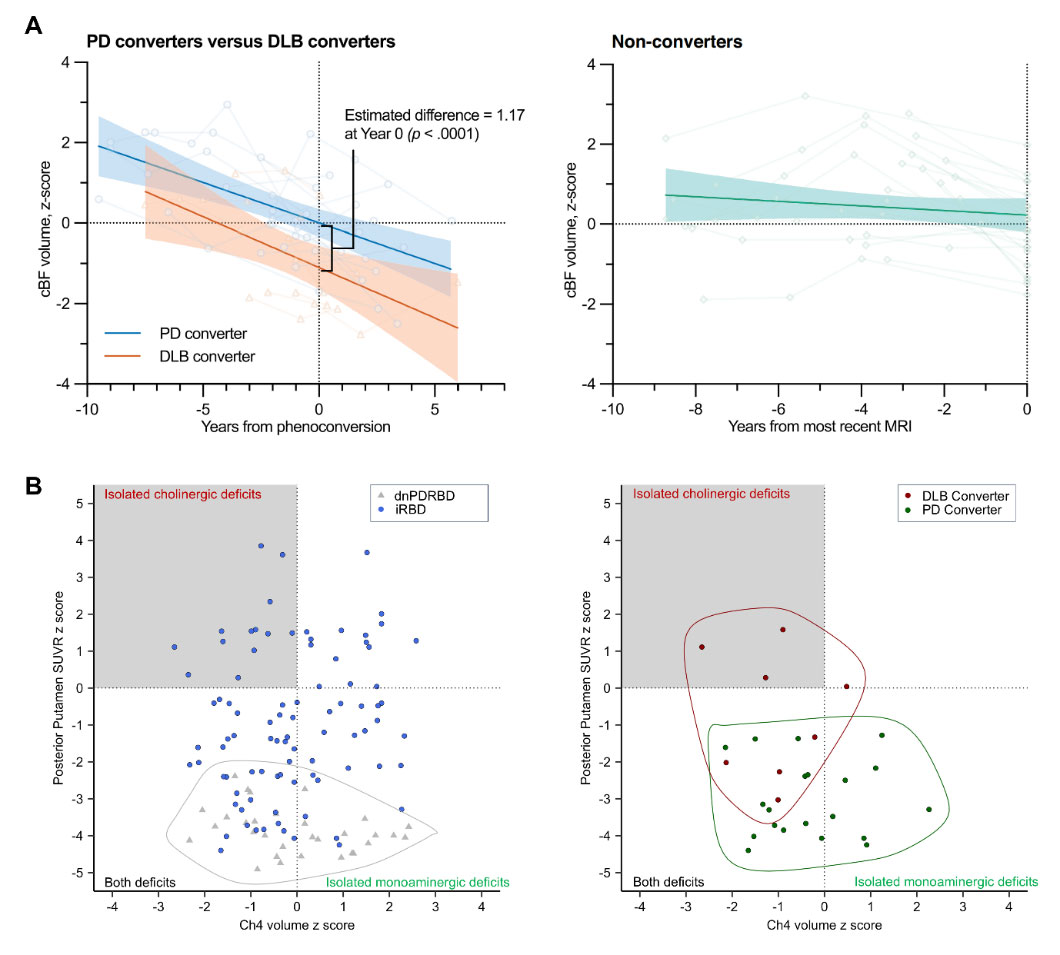
이지영 교수와 보라매병원 연구진은 2013년부터 구축한 iRBD 환자 코호트에서 수집한 뇌 MRI 및 도파민운반체 PET 영상을 분석하여 뇌 아세틸콜린신경계의 중심핵인 basal forebrain이 언제부터, 그리고 얼마나 빠른 속도로 진행하는지 보여주었는데(그림 A), 루이소체질환은 전구단계에서 basal forebrain의 anterior part보다는 posterior part에서 먼저 퇴행이 일어나며, 각각 전자는 인지기능, 후자는 운동기능의 결손과 관련이 있음을 확인하였다. 또한 basal forebrain의 위축 정도는 전구루이소체질환의 특징적 인지 형태인 전두엽성 실행능력 저하(Trail Making Test-B performance)와 상관관계를 보였으며, 이러한 위축 정도는 전구단계에서 향후 치매의 발생을 예측하는 강력한 지표임을 밝혔다.
아울러 본 연구에서는 iRBD 환자들이 세 가지 아형으로 분류될 수 있음을 확인하였다(그림 B). 이들은 각각 (1) 뇌 아세틸콜린 신경계의 퇴행이 먼저 나타나는 아형, (2) 도파민 신경계의 퇴행이 우선적으로 진행되는 아형, (3) 두 신경계의 퇴행이 동시에 나타나는 아형으로 특징지어진다. 전향적으로 추적한 iRBD 코호트 연구를 통해, 전자의 아형은 주로 루이소체치매로, 후자의 아형은 주로 파킨슨병으로 진행된다는 점을 확인하였다.
이번 연구결과는 각각 Alzheimer’s & Dementia 2025년 2월호와 Brain 2025년 6월 온라인판에 게재되었다.
논문링크 :
1) https://doi.org/10.1093/brain/awaf196
2) https://doi.org/10.1002/alz.14584
Inhibiting EZH2 complements steroid effects in Duchenne muscular dystrophy
Science Advances

(의학과/의과학과, 공동교신저자)

(소아과학교실, 공동교신저자)

(의과학과, 제1저자)
듀셴근이영양증(Duchenne muscular dystrophy, DMD)은 DMD 유전자의 돌연변이에 의하여 유발되며, 근육 약화와 퇴행을 주된 특징으로 하는 심각한 유전성 희귀질환이다. 국내에는 약 2,000명 이상의 환자가 있으며, 환자들은 이동성 상실과 호흡 곤란, 심장 합병증으로 인해 사망에 이를 수 있다. 주로 남아에게 영향을 미치며, 증상은 어린 시절 초기에 나타난다. 현재 완치 방법은 없으며, 스테로이드, 물리 치료가 유일한 치료법이다. 최근 일부 유전자 치료제의 임상시험이 활발하게 진행되고 있고, 일부 국가에서 시범적으로 허가된 유전자 치료제가 있으나 그 효과에 대해서는 아직 지켜봐야 하는 상황이다.
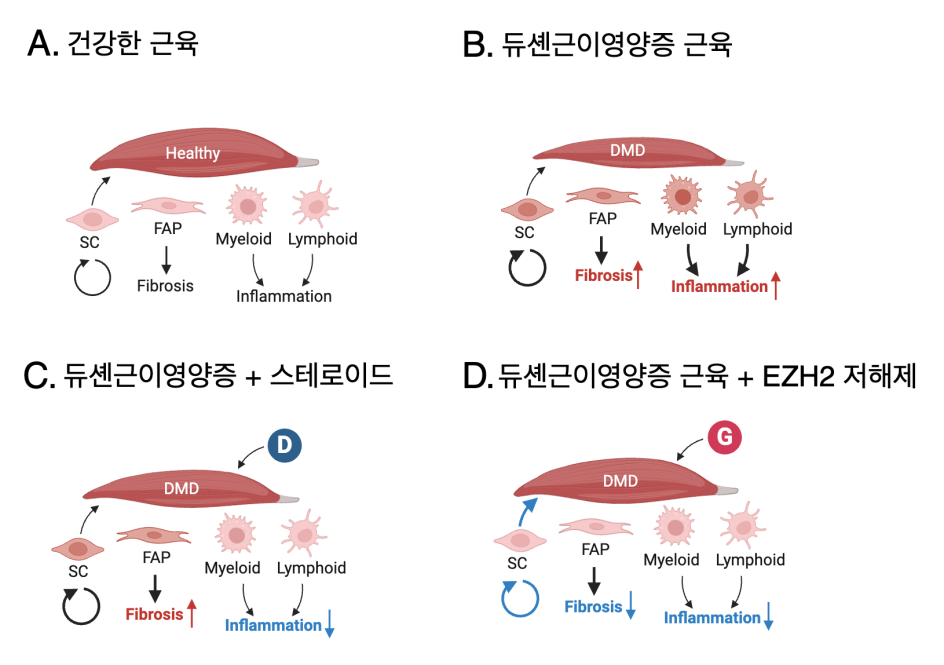
본 연구는 듀셴근이영양증에서 EZH2 억제의 치료적 가능성을 평가하기 위해 인간 환자와 생쥐 모델을 대상으로 수행되었다. 이를 위하여 연구진은 단일세포 전사체(single nuclei RNA-sequencing, snRNA-seq)와 공간 전사체 분석(spatial transcriptomics) 방법을 활용하여 환자 및 생쥐 모델의 근육 조직을 비교 분석하였다. 인간 환자의 경우 듀셴근이영양증 환자, 보다 증세가 약한 베커근이영양증 환자, 건강한 대조군의 근육 샘플을 수집하여 유전자 발현 변화를 조사하였으며, 생쥐에서는 듀셴근이영양증의 모델이 되고 있는 DMD 유전자 돌연변이 생쥐와 이 생쥐에 글루코코르티코이드(데플라자코트)를 처리한 생쥐를 포함하여 스테로이드 치료에 의한 효과를 알아보기 위한 실험도 동시에 진행하였다.
분석 결과, DMD 환자의 증식하는 위성세포(satellite cell)에서 EZH2 활성이 특이적으로 증가되어 있음을 발견했다. 또한, EZH2 억제제(GSK126, tazemetostat)를 단독 혹은 글루코코르티코이드와 병용 투여한 실험군을 설정하여 생쥐 실험을 수행하였고 조직 분석, 유전자 발현 패턴 분석, 근육 조직의 섬유화 및 근육 기능(악력 테스트 등)을 평가함으로써 EZH2 억제가 DMD 치료에 미치는 영향을 검증하였다.
본 연구는 EZH2 억제를 통해 면역 억제 효과를 유지하면서도 근육의 퇴화를 방지하여 DMD 생쥐 모델에서 근육 기능을 개선할 수 있음을 입증하였으며, 이러한 결과는 EZH2를 표적으로 하는 치료법이 기존 스테로이드 치료를 보완하여 듀셴근이영양증 치료에 새로운 가능성을 제시할 수 있음을 시사한다. 즉, 연구진은 EZH2의 역할을 보다 정밀하게 규명하고, 기존 스테로이드 치료의 단점을 보완할 수 있는 새로운 병용 치료 전략을 제시하였다. 이 연구는 DMD 치료의 패러다임을 확장하고, 향후 EZH2 억제제를 활용한 임상 연구 및 신약 개발의 기반이 될 수 있을 것으로 기대된다.
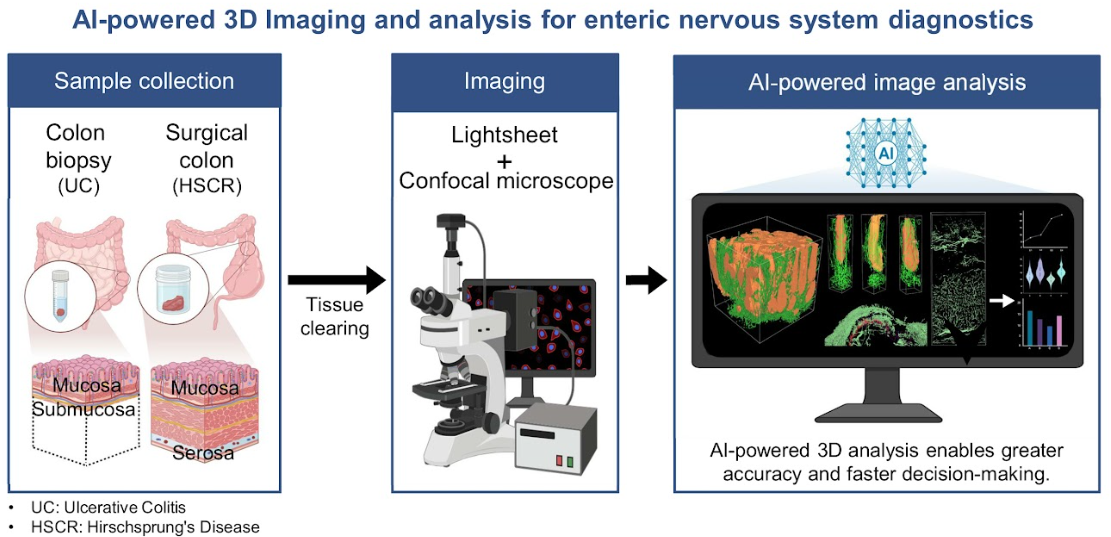
AI-powered 3D pathology protocol enhances enteric nervous system visualization and quantification for clinical diagnostics
Theranostics

(뇌인지과학과/해부학교실,
공동교신저자)

(내과학교실, 공동교신저자)

(해부학교실, 공동제1저자)

(의과학과, 공동제1저자)
서울대학교 뇌인지과학과/의과대학 해부학교실 최형진 교수 연구팀과 서울대학교 의과대학 내과학교실 고성준 교수 연구팀이 공동으로 인공지능(AI)과 3차원 이미징 기술을 접목한 통합 워크플로우를 개발해 기존 병리 분석의 구조적 한계와 시간적 제약을 극복하고 소화기 질환 진단의 정확도 향상과 시간 단축 가능성을 객관적으로 검증했다.
기존 조직병리학은 조직을 얇게 절단한 뒤 2차원적으로 관찰하는 방식으로 진행되어 왔으나, 이 과정에서 복잡한 구조적 정보가 왜곡되거나 손실될 수 있으며 병리적 변화를 정량적으로 평가하는 데 한계가 있었다. 특히 장 신경계와 같은 미세하고 복잡한 구조를 정확히 진단하기 어려워 진단 지연, 왜곡, 정량화의 어려움이 발생했다. 이러한 문제를 해결하기 위해 연구팀은 3차원 조직 투명화(tissue clearing) 기술 기반의 샘플 처리 프로토콜을 개발하고, 이를 AI 기반 자동 분석 시스템과 통합함으로써 혁신적 분석 워크플로우를 제시하였다.
최적화된 프로토콜을 적용할 경우, 대장 생검은 약 8일, 수술 샘플은 약 12일 이내 분석 가능하여 기준 대비 시간이 대폭 단축됐다. 사전 훈련된 AI 모델을 통한 자동 3D 재구성과 분석을 통해, 생검 샘플은 최대 1000배, 수술 샘플은 최대 30배의 분석 속도가 향상됐다. 기존 non-AI 영상은 형광 강도 기반 단순 재구성으로 장 점막과 신경구조의 명확한 구분이 어려웠으나, AI 분석은 크립트와 신경 섬유의 3D 연결성과 병리 구조의 변형까지 정밀하게 시각화했다. 특히 허쉬스프룽병 수술 샘플에서도 자가형광 등 방해 신호를 제거하고, 점막층부터 신경총까지 층별 분석과 정량화가 가능하였다. AI 분석은 수작업 분석과 유사한 수준의 정량 정확도를 보였으며, non-AI 방식보다 훨씬 신뢰도가 높았고 특히 부피, 경로 길이 등 non-AI 방식으로는 측정 불가능한 지표까지 분석 가능하여, AI 분석 기술의 필요성을 확인하였다.
해당 기술은 복잡한 장 신경계 구조를 빠르고 정확하게 분석할 수 있는 혁신적인 진단 도구로, 향후 염증성장질환, 대장암, 과민성대장증후군, 허쉬스프룽병 등 다양한 장 질환의 조기 진단, 예후 예측, 맞춤형 치료 전략 수립에 기여할 것으로 기대된다.