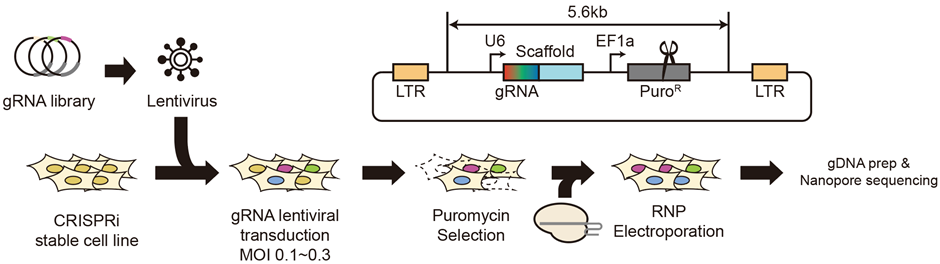
[연구동향]
Large DNA deletions occur during DNA repair at 20-fold lower frequency for base editors and prime editors than for Cas9 nucleases
Nature Biomedical Engineering

(생화학교실,교신저자)

(유전체의학연구소,공동제1저자)

(의과학과,공동제1저자)
본 연구는 서울대학교 의과학과 배상수 교수 연구팀이 서울대학교 컴퓨터공학부 김선 교수, 서울대학교 첨단융합학부 김찬혁 교수 연구팀과 함께 공동으로 수행한 연구로, 크리스퍼 유전자 편집 과정에서 발생할 수 있는 큰 DNA 손실에 관한 연구이다.
크리스퍼-카스 시스템을 이용한 유전자 편집 기술은 기초 연구부터 유전질환 치료까지 다양한 분야에 적용된다. 특히 마땅한 치료제가 없는 유전성 희귀 난치 질환의 근본적인 원인이 되는 DNA 돌연변이를 교정해낼 수 있다는 점 때문에 크게 각광받고 있다. 하지만 DNA는 한 번 편집되면 영원히 유지된다는 점에서 보다 높은 정확도와 적은 부작용이 요구된다. 따라서 현재 개발된 크리스퍼 기술 기반의 유전자 편집 도구들의 안전성을 확인하는 것은 매우 중요한 일이다.
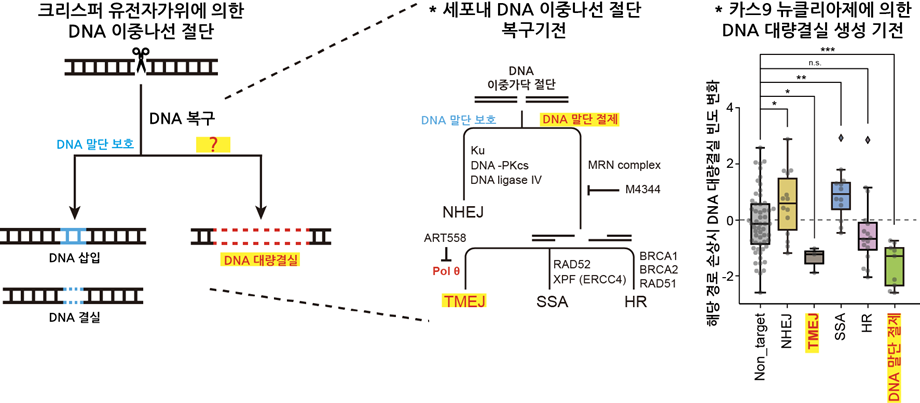
최근 크리스퍼 유전자가위에 의해 DNA의 이중나선이 절단되고 나면 예상과 다르게 수백, 수천 개의 긴 DNA 염기서열이 손실되는 결과가 보고된 바 있는데, 아직까지 그 기전은 밝혀지지 않았다. 본 연구에서는 약 800여 개 유전자에 대한 유전자 스크리닝 기법을 통해 긴 DNA 염기서열 손실과 관련이 있는 유전자들을 새롭게 발굴했다. 그리고 이를 통해 긴 DNA 염기서열 손실은 DNA 수선기작들 중 DNA 말단 절제 및 POLQ 중합효소에 의한 수선(TMEJ; Pol theta-mediated end joining)과 긴밀하게 연관되어 있다는 것을 처음으로 규명했다.
본 연구에서는 더 나아가서 크리스퍼-카스9 유전자가위 외에 염기교정 및 프라임교정 유전자가위에 대해서도 연구를 진행했다. 염기교정 및 프라임교정 기술은 DNA의 이중나선을 완전히 절단하지 않은 채 각각 특정 염기를 치환하거나 수십개의 염기서열을 편집할 수 있는 기술이다. 본 연구 결과 염기교정 및 프라임교정 유전자가위 모두 비록 20배 정도의 낮은 빈도지만, 긴 DNA 염기서열 손실을 동일하게 발생시킨다는 것을 처음으로 밝혀냈다.
이렇게 긴 DNA 염기서열 손실의 발생과 그 원인을 규명함으로써, 향후 보다 안전하고 정확한 유전자 편집을 통해 유전자 치료가 가능할 것으로 기대된다.
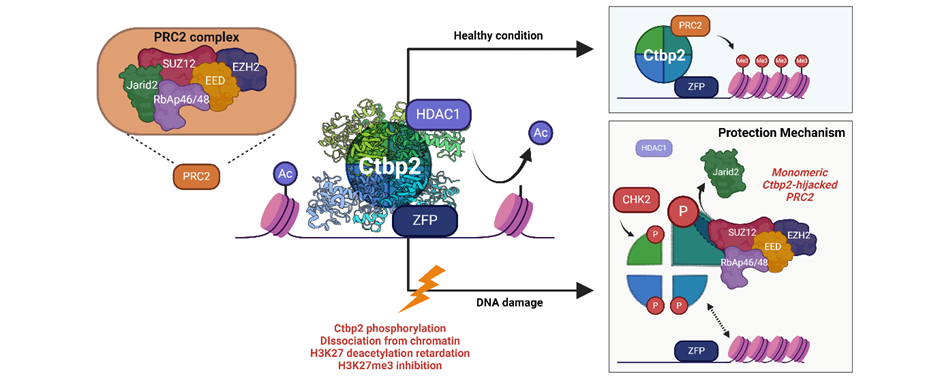
Phosphorylation-mediated disassembly of C-terminal binding protein 2 tetramer impedes epigenetic silencing of pluripotency in mouse embryonic stem cells
Nucleic Acids Research

(생화학교실,교신저자)

(생화학교실,제1저자)
세포의 정체성(identity)은 세포가 수행하는 기능을 결정하는 핵심 요소로, 이는 복합적인 유전자 발현 패턴에 의해 정의된다. 후성유전학적 조절은 DNA 서열에 변화를 가하지 않으면서도 유전자 발현을 동적으로 변화시키는 메커니즘으로, 세포가 환경적 신호나 스트레스에 신속히 대응하는 데 핵심적인 역할을 담당한다. 특히 높은 위계(hierarchy) 상태에서 전분화능(pluripotency)을 유지하는 줄기세포는 유전자 발현의 이상 발생 시 하위 모든 세포에 영향을 줄 수 있다는 점에서 더욱 철저히 이를 통제해야 한다. 기존 연구에서는 줄기세포가 외부로부터 스트레스를 받을 경우, 잘못된 유전적 또는 후성유전학적 정보가 후세대에 전달되는 것을 방지하기 위해 분화나 세포 사멸을 선택한다고 알려져 왔다. 그러나 줄기세포는 빈번히 발생하는 다양한 스트레스 상황에서 자신의 전분화능이 손실되는 위험에 직면할 수 있다는 점에서, 이러한 전략은 역설적인 결과를 초래할 수 있다.
본 연구는 줄기세포 전분화능 탈출 조절의 핵심인자인 CTBP2가 DNA 손상상황에서 활성화되는 CHK2를 통해 인산화되어 단량체로 해리되며, 이는 CTBP2의 결합 파트너를 NuRD 복합체에서 PRC2 복합체로 전환하는 효과가 있음을 확인했다. 그 결과 CTBP2는 H3K27 탈아세틸화와 H3K27 메틸화를 저해하는 기능이 있음을 입증했다. 즉, DNA 손상 상황에서 줄기세포가 스트레스를 인지하고 복구 기전을 활성화시키는 동안, 자신의 전분화능을 유지하기 위해 작동하는 후성유전학적 보호 메커니즘이 존재함을 규명한 연구이다. 이를 통해 줄기세포가 줄기성 상실 위기를 극복하기 위한 정교한 보호 기전을 갖추고 있음을 증명했으며, 이는 줄기세포 생물학 및 후성유전학적 세포 정체성 유지 연구에 중요한 통찰을 제시한다.
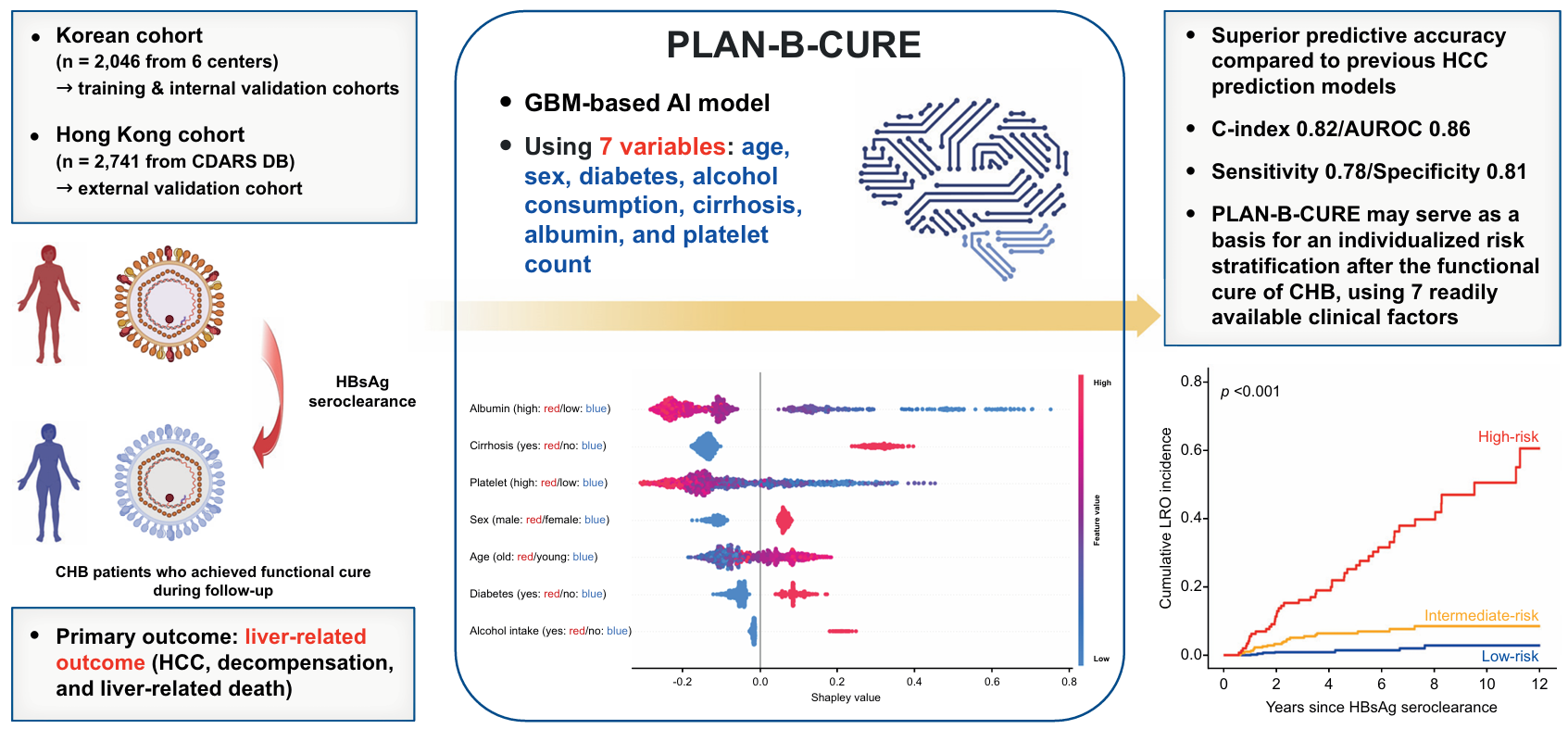
A machine learning model to predict liver-related outcomes after the functional cure of chronic hepatitis B
Journal of Hepatology

(의학과,교신저자)

(서울대학교병원 소화기내과,
공동제1저자)

(마취통증의학교실,공동제1저자)
만성 B형간염 환자들은 간경화, 간암의 발생 위험이 높은 고위험군으로 6개월 간격의 감시검사가 권장된다. 일부 만성 B형간염 환자들은 B형간염 바이러스 표면항원(HBsAg)이 자연적으로 소실되는데 이를 기능적 완치로 분류하며, 이 경우 추후 간암, 간경화 합병증의 발생 위험도가 감소하는 것으로 알려져 있다. B형간염 바이러스를 효과적으로 억제시키는 강력한 항바이러스제가 이미 보편적으로 사용되고 있고, 기능적 완치 달성을 위한 여러 신약들이 개발 중에 있어 앞으로 기능적 완치에 도달하는 만성 B형간염 환자수가 증가할 것으로 기대된다. 그러나 기능적 완치 이후에도 간암, 간경화 합병증 발생 위험은 여전히 존재하고, 그 위험도는 일반 인구에 비해 월등히 높음에도 해당 환자군에서 어떻게 감시 검사를 시행하고 합병증을 관리해야 하는지에 대한 연구와 가이드라인은 부족하다. 따라서 본 연구에서는 대규모 다국적-다기관 코호트를 활용하여 기능적 완치가 된 만성 B형간염 환자에서 추후 간 관련 질환 발생 위험도를 예측하는 인공 지능 모델을 개발 및 검증하고자 했다.
본 연구진은 서울대학교병원을 포함한 국내 6개 기관에서 만성 B형간염으로 추적 관찰 중 기능적 완치가 확인된 2,046명의 환자 정보를 후향적으로 수집하고, 이들을 모델 훈련 코호트와 내부 검증 코호트로 나누었다. 모델에 사용되는 변수를 결정하기 위해 기능적 완치 이후 간 관련 질환(간암, 간경화 합병증, 간 관련 사망) 발생 위험과 관계있는 인자를 Cox 비례 위험 분석을 통해 확인했다. 최종적으로 총 7개의 변수(나이, 성별, 간경화 유무, 혈소판 수치, 혈액 알부민 수치, 당뇨 유무, 유의한 음주 여부)가 모델의 입력 값으로 결정됐다. 7개의 변수와 여러 기계 학습 알고리즘을 활용하여 후보 모델을 구축했고 훈련 코호트에서 가장 높은 정확도를 보여 준 gradient boosting machine (GBM) 알고리즘 기반 모델을 최종 모델로 선정한 뒤 PLAN-B-CURE (Prediction of Liver-related outcomes using Artificial intelligence-driven model for Network – after chronic hepatitis B functional CURE)로 명명했다. PLAN-B-CURE 모델은 훈련 코호트에서 c-index 0.82 (95% 신뢰구간 0.76–0.88), 내부 검증 코호트에서 c-index 0.85 (95% 신뢰구간 0.79–0.90)의 높은 정확도를 보여 주었다. 추가적으로 본 모델을 독립된 코호트에서 검증하기 위해 홍콩의 연구자들과 협력해 대규모 코호트를 확보했고, 외부 검증 코호트에서도 c-index 0.81 (95% 신뢰구간 0.77–0.85)의 높은 예측 정확도가 확인됐다. PLAN-B-CURE는 기존의 간암 발생 예측 모델들에 비해 우수한 정확도를 보여 주었으며, PLAN-B-CURE의 예측값에 따라 환자들을 세 위험그룹으로 구분했을 때 통계적으로 유의한 차이가 있음을 확인했다.
PLAN-B-CURE와 같은 기계 학습 기반 모델은 전통적인 통계 모델에 비해 입력 변수와 결과 변수 간의 복잡한 비선형적 관계를 보다 정확하게 반영할 수 있어, 최근 의학의 여러 분야에서 활용되고 있다. 본 연구진은 실제 진료 현장에서 쉽게 얻을 수 있는 7개의 변수를 활용해 만성 B형간염의 기능적 완치 이후 간 관련 질환의 발생 위험도를 예측하는 기계 학습 모델을 개발하고, 국내외 대규모 코호트를 활용해 그 성능을 검증했다. 또한 만성 B형간염의 기능적 완치 이후에도 당뇨, 음주와 같은 대사 인자를 적극적으로 조절하는 것이 중요함을 확인했다. PLAN-B-CURE를 활용해 기능적 완치에 도달한 만성 B형간염 환자군의 추후 합병증 발생 위험도 예측, 개별화된 위험인자 관리와 감시 전략 수립이 가능할 것으로 기대된다.