[연구동향]
Amyloid-β-activated microglia can induce compound proteinopathies
Brain

(의과학과,교신저자)

(신경과학연구소,제1저자)
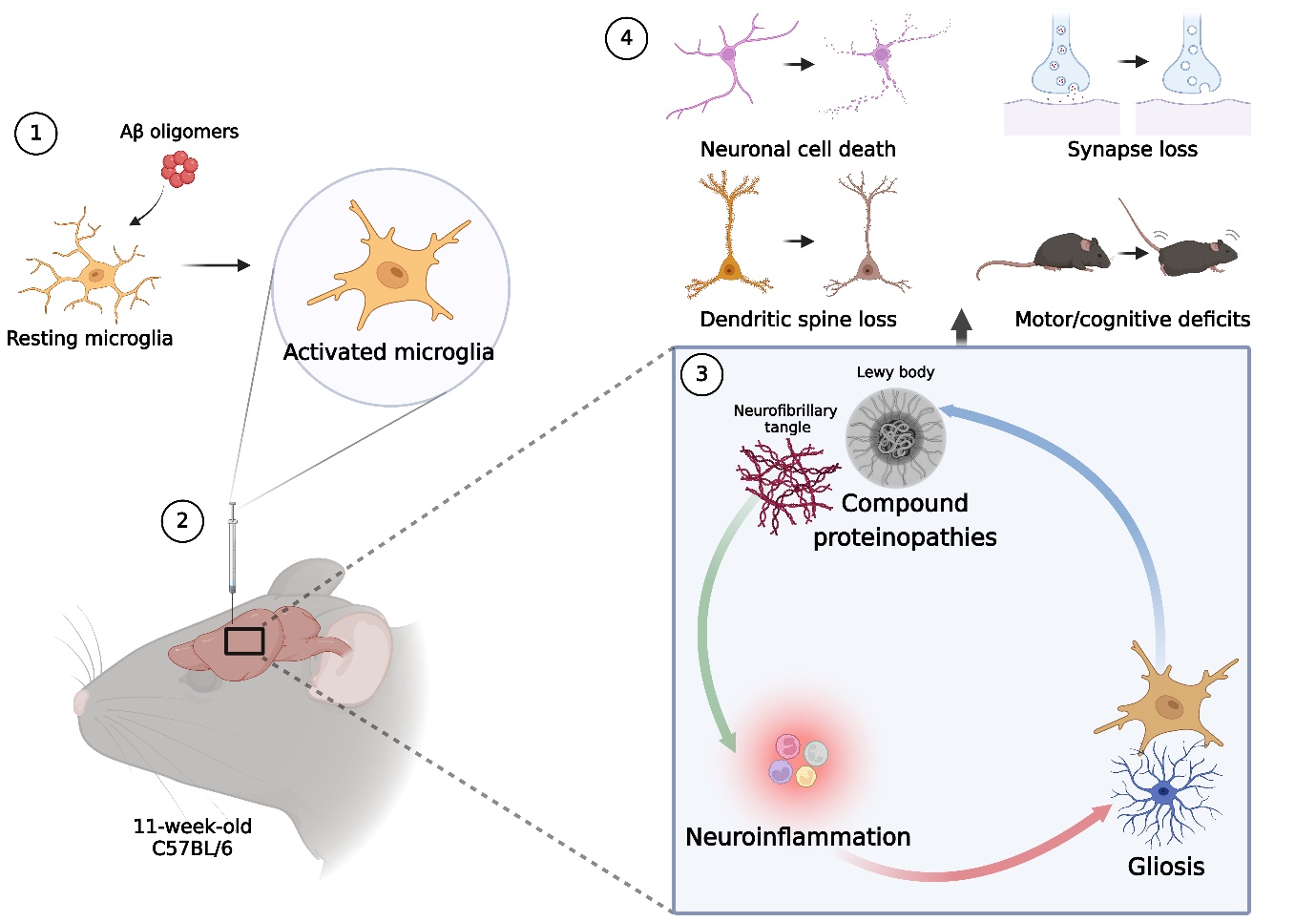
본 연구는 활성화된 미세아교세포가 신경퇴행성 질환의 모든 특징을 유도할 수 있음을 보여 주었다. 알츠하이머 병은 아밀로이드 플라크, 신경섬유 다발, 그리고 루이소체가 형성되는 복합적인 신경병리학적 특징을 보이지만, 이들 단백질병증이 어떻게 상호 연결되어 있는지는 아직 충분히 이해되지 않았다. 본 연구에서는 Aβ 올리고머로 활성화된 미세아교세포를 야생형 마우스의 선조체에 이식했을 때, 광범위한 타우병증과 시누클레인병증, 신경교증, 신경 염증, 시냅스 손실, 신경 세포 사멸, 그리고 인지 및 운동 기능 저하와 같은 신경퇴행성 질환의 모든 특징이 나타남을 확인하였다. 이러한 신경병리학적 변화는 주입 부위에 국한되지 않고 넓은 뇌 영역으로 점진적으로 퍼지며, 이는 신경퇴행성 질환의 중요한 특징을 재현한 것이다. 또한 Aβ 올리고머 자체를 주입했을 때에도 타우병증과 시누클레인병증이 유발되었지만, 그 정도는 활성화된 미세아교세포를 주입한 경우에 비해 훨씬 약하게 나타났다. 아울러, Aβ 올리고머가 유발한 단백질 병증은 CSF1R 억제제를 이용해 미세아교세포를 고갈시켰을 때 완전히 사라졌다.
일반적으로 야생형 마우스의 뇌에 병리학적 타우나 아밀로이드 베타를 주입하면 단백질 병변이 유도되기까지 최소 2개월 이상이 걸리는 반면, 활성화된 미세아교세포는 주사 후 수 주 만에 심각한 신경병리와 행동 장애를 유발했다. 기존의 교차 접종(cross-seeding) 메커니즘은 서로 다른 단백질 응집체 간의 물리적 상호작용을 필요로 하는 반면, 이번 연구의 미세아교세포 주사 모델은 단백질 응집을 촉진하는 미세환경의 변화를 중심으로 설명된다. 즉, Aβ 올리고머가 미세아교세포를 활성화해 염증성 미세환경을 조성하고, 이 환경이 타우 및 알파-시누클레인과 같은 병원성 단백질의 응집을 촉진하는 것이다. 이는 복합적인 단백질 병증이 스스로 확산하기보다는, 신경염증 반응에 의해 2차적으로 발생하는 것임을 시사한다.
미세아교세포가 Aβ와 타우/알파-시누클레인 간의 매개체 역할을 한다는 본 연구 결과는 신경퇴행성 질환에 대한 새로운 치료법 개발에 중요한 영향을 미칠 것으로 기대된다.
Screening Outcomes of Mammography with AI in Dense Breasts: A Comparative Study with Supplemental Screening US
Radiology

(서울대학교병원 영상의학과,
교신저자)

(영상의학교실,제1저자)
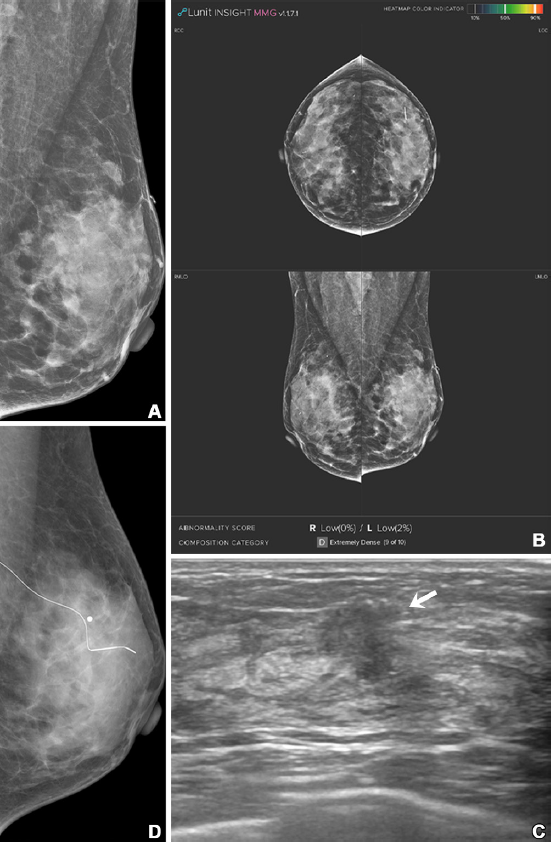
본 연구에서는 2017~2018년 유방암 검진을 받은 40세 이상 치밀 유방 여성 5,707명을 대상으로 단독 유방촬영술, 유방촬영술+인공지능 병합, 유방촬영술+초음파 병합 진단 결과를 각각 비교 분석했다. 그 결과, 유방촬영술+인공지능 병합의 경우 단독 검사보다 특이도가 높고(95.3% vs 94.3%), 재검률이 낮았다(5% vs 6%). 즉 인공지능 보조진단 프로그램을 병행하면 정상인을 음성으로 진단하는 특이도가 개선되고, 정상인이지만 유방암으로 진단받는 위양성 사례를 줄일 수 있었다. 반면, 유방암을 양성으로 진단하는 민감도는 유방촬영술+초음파 병합이 유방촬영술+인공지능 병합보다 높았다(97% vs 60.6%). 그 밖에도 유방촬영술+인공지능 병합으로 진단을 놓쳤지만 유방초음파를 통해 추가 진단된 12개의 유방암은 림프절 전이가 없는 조기 유방암으로, 연구팀은 유방암 조기 진단에 있어서 유방초음파를 병행하는 것이 중요하다고 강조했다.
Proximal Location of Optic Disc Hemorrhage and Glaucoma Progression
JAMA Ophthalmology

(안과학교실,교신저자)

(현 가천대학교 길병원 안과/
서울대학교 의학과 박사과정,
제1저자)
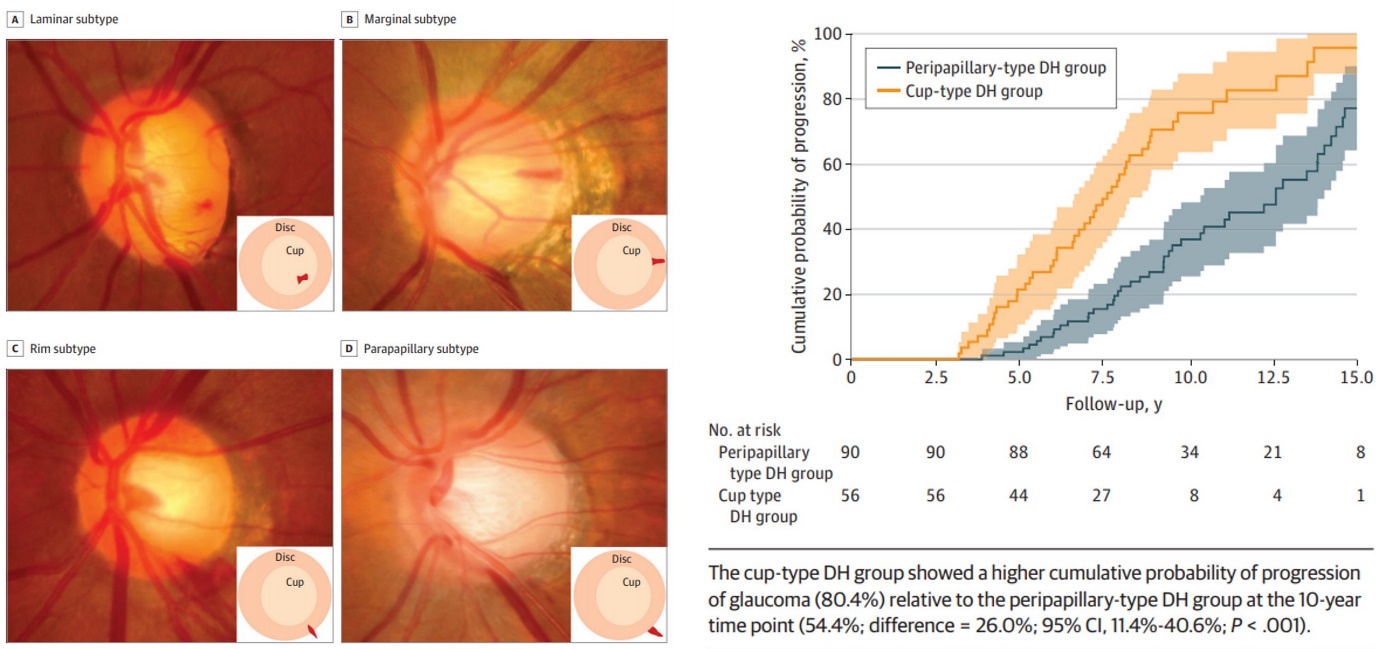
시신경유두출혈은 잘 알려진 녹내장 발생 및 진행의 위험인자이나 그 병태생리나 녹내장 진행에 영향을 미치는 기전이 완전히 밝혀져 있지 않다. 서울대학교 의과대학 안과학교실 정진욱 교수 연구팀에서 수행한 본 연구에서는 개방각 녹내장 환자 코호트를 장기간 추적 관찰하여 시신경유두출혈의 발생 위치가 녹내장 진행에 미치는 영향을 규명하고자 하였다. 시신경유두출혈을 1회 이상 경험하였으며, 시신경유두출혈 발생 이후 평균 11년 경과 관찰한 146명 146안의 개방각 녹내장 환자를 시신경유두출혈의 발생 위치에 따라 네 군으로 나누었으며, laminar와 marginal형은 cup-type군으로, rim과 parapapillary형은 peripapillary-type군으로 나누어 두 군의 장기적 녹내장 진행 양상을 비교하였다. Cup-type군이 시야 결손 속도가 유의하게 빠르게 나타났으며, 생존분석에서 유의미하게 높은 녹내장 진행 확률을 보이는 것을 알 수 있었고, 비례위험분석에서 cup-type 시신경유두출혈이 녹내장 진행 위험을 높이는 것을 알 수 있었다(HR, 3.28). 또한 peripapillary-type군은 시신경유두출혈이 한번도 발생하지 않은 군과 비교하였을 때 녹내장 진행 속도에 유의한 차이가 없었다. 본 연구를 통하여 시신경유두출혈 중에서도 시신경 유두의 안쪽 중심부에 발생한 출혈이 임상적인 의미를 갖는 녹내장 진행의 지표임을 알 수 있었으며, 이는 시신경유두출혈 발생 위치와 관련하여 진행된 최초의 장기 경과 관찰 연구이다. 시신경유두출혈이 녹내장 진행에 영향을 미치는 기전에 대한 가설로 중심부의 시신경유두출혈 발생이 사상판을 지나는 망막신경절세포의 축삭 흐름에 영향을 줄 가능성이 제시되고 있는데, 본 연구는 해당 가설에 대한 임상적인 근거를 제시한다는 면에서 중요한 의의를 지닌다.
Genome-wide CRISPR screening identifies tyrosylprotein sulfotransferase-2 as a target for augmenting anti-PD1 efficacy
Molecular Cancer

(생화학교실,공동교신저자)

(의학연구원 유전체의학연구소,
공동제1저자)
이번 연구는 서울대학교 의과대학 생화학교실 연구팀과 광주과학기술원 의생명공학과 박한수 교수 연구팀이 공동으로 수행한 연구로, 암 면역 치료(특히 면역 관문 억제제 치료)의 효과를 높일 수 있는 새로운 치료 타겟을 제시한 연구이다. 암 면역 치료는 환자의 면역 체계가 암세포를 공격하도록 유도하는 치료법으로, PD-1과 같은 면역 관문 단백질을 차단하는 약제가 널리 사용되고 있다. 그러나 일부 암 환자들은 이러한 면역 치료에 반응하지 않거나, 시간이 지나면서 치료에 대한 저항성이 생기는 문제가 있다. 이를 해결하기 위해, 암세포가 어떻게 면역 치료에 저항하는지를 분자 수준에서 이해하는 것이 중요하다.
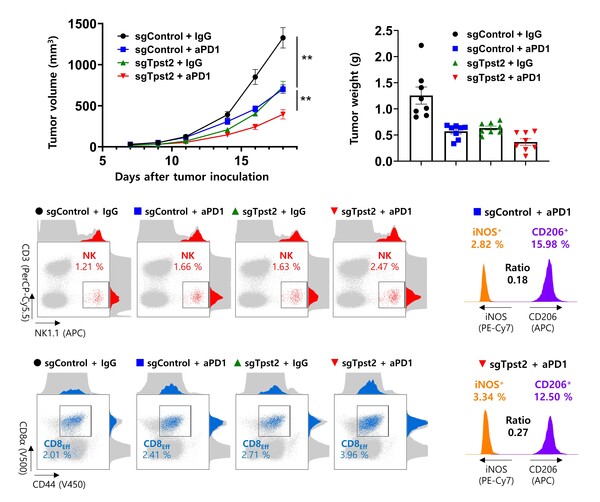
이 연구에서는 tyrosylprotein sulfotransferase-2(TPST2)라는 효소가 암세포에서 면역 치료에 저항성을 일으키는 중요한 요소임을 제시하였다. TPST2는 단백질의 타이로신 잔기에 sulfate 그룹을 붙이는 역할을 하는 효소로, 세포막에서 이루어지는 면역 신호를 조절하는 역할을 하는 것으로 알려져 있다. IFN-γ는 암세포가 면역 세포에 의해 인식되고 공격받도록 하는 중요한 신호이지만, TPST2가 이 신호를 억제하여 암세포가 면역 치료에 덜 반응하게 만든다. 연구진은 CRISPR-Cas9 기술을 사용하여 TPST2의 기능을 억제했을 때, 암세포의 IFN-γ 신호가 강화되고 항원 제시가 증가하여 암세포가 면역 세포에 더 잘 인식된다는 사실을 확인했다.
또한, TPST2가 억제된 암세포는 면역 관문 억제제인 anti-PD1 치료에 더 잘 반응했다. 이는 암세포의 IFN-γ 신호가 강화되면서 T세포와 NK세포와 같은 면역 세포들이 암세포를 더 효과적으로 공격했기 때문이다. 실제로, TPST2가 억제된 실험군에서는 종양 크기가 줄어들고, 면역 세포의 침투가 증가하는 결과를 보였다. 추가적으로 암 환자의 데이터 분석 결과 일부 암종에서 TPST2 발현이 높은 암 환자들이 더 나쁜 예후를 보인다는 점도 확인되었다. TPST2 발현이 높은 환자들은 면역 치료에 대한 반응이 낮고, 생존율도 낮다는 점에서 TPST2는 중요한 암 면역 억제 요소로 작용함을 알 수 있다.
이 연구의 핵심 의의는 TPST2가 암세포의 면역 회피 기전에 중요한 역할을 한다는 사실을 발견하고, 이를 억제하면 면역 치료의 효과를 높일 수 있다는 점이다. 따라서 TPST2를 표적으로 하는 새로운 암 치료법 개발에 대한 가능성을 제시하고 있으며, 이는 기존 면역 치료의 한계를 극복할 수 있는 중요한 전략이 될 수 있다.

논문링크 : https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02068-x

