[연구동향]
Thromboembolism after coronavirus disease 2019 vaccination in atrial fibrillation/flutter: a self-controlled case series study
European Heart Journal

(내과학교실,교신저자)

(서울대학교병원 순환기내과,
공동제1저자)

(서울대학교병원 순환기내과,
공동제1저자)
COVID-19 팬데믹 이후 전 세계적으로 많은 사람들이 코로나 백신을 접종했고, 이에 따라 백신의 안전성에 대한 관심이 높아졌다. 특히, 코로나 백신이 심근경색이나 뇌졸중 등 색전성 합병증을 일으킨다는 것이 여러 차례 보고됨에 따라, 심방세동(atrial fibrillation) 및 심방조동(atrial flutter) 환자와 같이 이미 혈전색전증 위험이 높은 집단에서 백신 접종이 추가적인 위험을 유발할 수 있는지에 대한 우려가 있었으나, 기존에는 이에 대한 연구가 부족했다. 이에 따라 김형관 교수팀에서는 심방세동/조동 환자에서 COVID-19 백신 접종 후 혈전색전증의 위험을 평가하는 대규모 연구를 진행하였다.
이 연구는 전국민의 25%를 무작위 샘플링한 약 1235만 명의 대규모 데이터에서 분석이 이루어졌으며, 이 중에는 141,855명의 심방세동/조동 환자가 포함되었다. 심방세동/조동 환자 중에서 2021년 2월부터 12월까지 COVID-19 백신을 접종 받은 환자의 수는 약 88.6%로, 124,127명이었다. 연구에서는 백신 접종 후 21일 동안의 위험 기간 동안 발생한 혈전색전증(허혈성 뇌졸중, 일과성 허혈 발작, 전신 색전증)을 주요 결과로 설정하고, 비위험기간과 비교해 위험 변화를 분석했다. 연구 결과, 전체적으로 백신 접종 후 심방세동/조동 환자에서 혈전색전증의 위험이 유의미하게 증가하지 않았으며(Incidence rate ratio, 발생률비 0.93, 95% 신뢰구간 0.77–1.12), 이러한 연구결과는 사망한 환자를 제외한 민감도 분석에서도 일관되게 유지되었다. 특히, 하위그룹 분석에서도 연령이나 성별에 따라 차이 없이 안전함을 보였으며, 또한 백신의 종류(화이자, 모더나, 아스트라제네카)에 따른 위험 차이도 발견되지 않았다.
그러나 연구는 항응고제를 복용하지 않은 환자들에서 백신 접종 후 혈전색전증의 위험이 약 2배 증가한 것을 확인했다(발생률비 1.88; 95% 신뢰구간 1.39–2.54). 이는 항응고제를 복용하지 않은 심방세동/조동 환자에서 백신 접종 후 주의가 필요함을 시사한다. 이러한 결과는 백신 접종 시 항응고제 사용의 필요성을 재검토하게 만들며, 임상 실무에 중요한 시사점을 제공한다.
코로나 감염은 잠시 소강 추이를 보이다 다시 증가 추세이다. 팬데믹을 넘어 엔데믹 상태로 들어온 코로나 감염에 대해서, WHO나 미국 및 유럽의 질병관리청에서는 심방세동/조동과 같은 기저질환자에서 코로나 백신 및 부스터 접종을 주기적으로 접종하는 것을 권고하고 있다. 이러한 권고에 대해서, 이 연구는 COVID-19 백신이(이미 혈전색전증의 위험이 높은) 심방세동/조동 환자에게 안전하며, 일반 인구와 마찬가지로 이러한 환자들에게도 백신 접종이 권장될 수 있음을 시사한다. 다만, 항응고제를 복용하지 않는 환자들에서는 백신 접종 후 혈전색전증 위험이 증가할 수 있으므로, 백신 접종 전후의 관리에 있어 신중한 접근이 필요하다. 이 연구는 공중 보건 정책과 진료의들의 임상 실무에 중요한 가이드라인을 제공할 수 있으며, AF/AFL 환자에서 색전성 합병증과 관하여서 COVID-19 백신 접종의 안전성을 강조하는 데 기여할 것이다.

Microglia gravitate toward amyloid plaques surrounded by externalized phosphatidylserine via TREM2
Advanced Science

(생화학교실,교신저자)

(박사과정,공동제1저자)
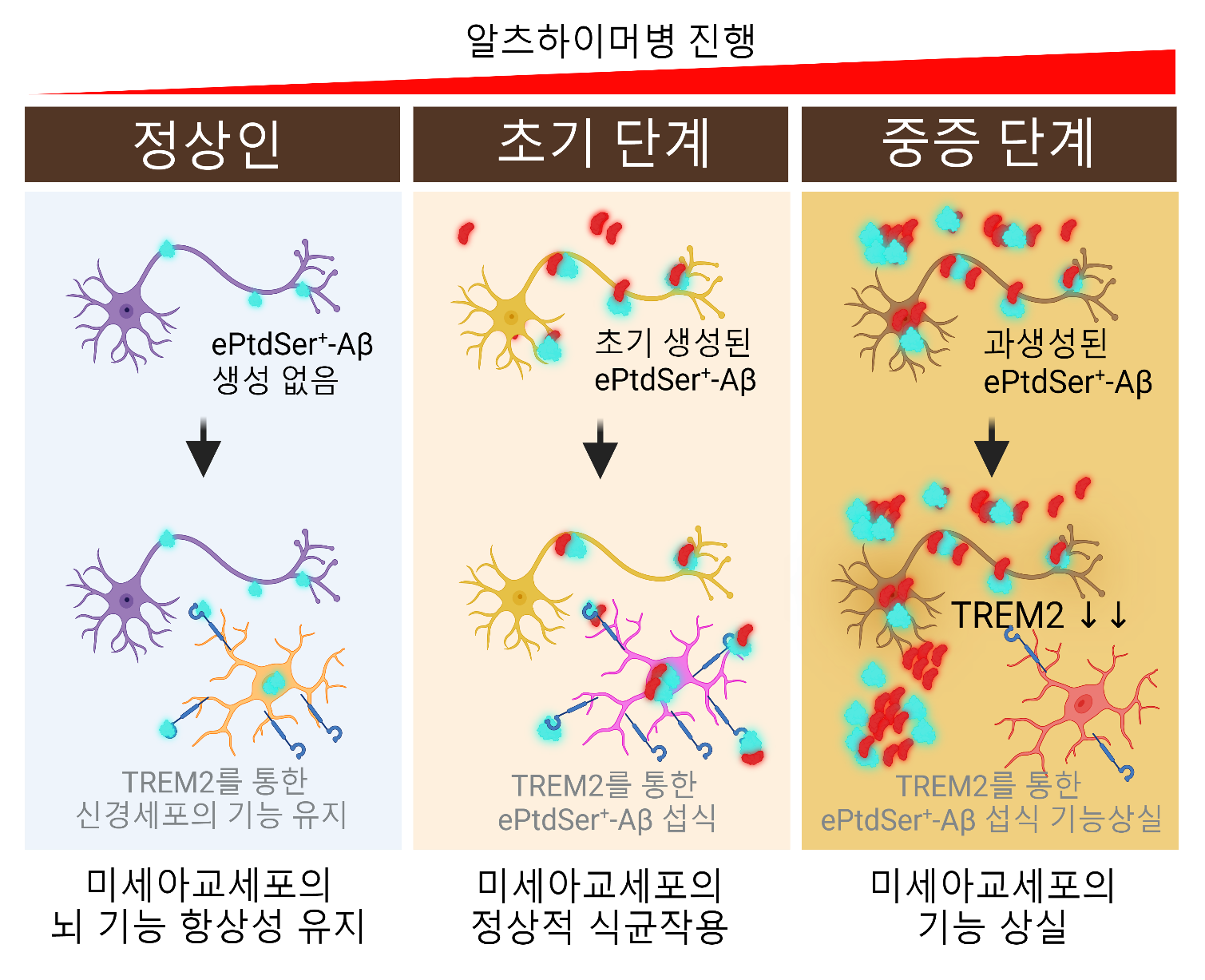
서울대학교 의과대학 묵인희 교수 연구팀과 성균관대학교 생명물리학과 박종찬 교수 연구팀과 함께 알츠하이머병(AD) 진행 중 ePtdSer(외부화된 포스파티딜세린)이 TREM2 의존성 미세아교세포의 식균작용에 중요한 역할을 한다는 새로운 메커니즘을 규명했다. 알츠하이머병은 인지장애와 기억 손상으로 특징되는 퇴행성 뇌질환으로, 뇌 내 베타아밀로이드(Aβ)와 타우 단백질의 과도한 축적이 신경세포 손상과 지속적인 신경염증을 유발한다. 미세아교세포는 뇌와 척수의 주요 신경아교세포로, 정상적인 뇌 기능 유지와 신경 보호에 중요한 역할을 하며 Aβ 및 신경섬유 엉킴 제거에 기여한다. 연구에 따르면, 미세아교세포는 신경세포 표면에 노출된 ePtdSer을 인식하여 시냅스를 가지치기하고, 이 과정은 TREM2 수용체에 의해 조절된다. 연구팀은 2D/3D/4D 첨단 배양 시스템을 이용해 Aβ 플라크를 둘러싼 영양 장애 뉴런에서 생성된 ePtdSer이 미세아교세포의 TREM2를 통해 Aβ 제거를 가속화하는 것을 확인했다. 이 과정에서 TREM2 수용체가 ePtdSer을 인지해 Aβ를 제거하는 데 중요한 역할을 하며, TREM2와 Aβ의 상호작용이 ePtdSer 같은 외부 신호에 의해 조절된다는 새로운 사실을 밝혀냈다. 또한, 연구팀은 CRISPR-Cas9 기반 산발성 알츠하이머병 모델과 가족성 알츠하이머병 모델을 사용해 TREM2 수준이 감소한 미세아교세포에서 ePtdSer 양성 Aβ 플라크에 대한 식균작용이 부족함을 확인했다. 이번 연구는 Aβ 플라크 제거에서 ePtdSer와 TREM2의 역할을 규명해, 알츠하이머병 치료에 대한 새로운 시각을 제시한 중요한 진전으로 평가되며 미세아교세포가 어떻게 Aβ 병변에 이끌리고, 이를 처리하는지를 밝힘으로써, 면역기반 알츠하이머병 치료에 새로운 전망을 제공할 것으로 기대되는 연구 결과이다.
논문링크 : https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202400064
Assessing glaucoma severity and progression in individuals with asymmetric axial length - An intrapatient comparative study
Ophthalmology

(안과학교실,교신저자)

(서울대학교병원 임상강사/현
영남대학교병원 안과,제1저자)
이번 연구는 서울대학교 의과대학 안과학교실 박기호 교수 연구팀이 수행한 연구로, 비대칭 안축장을 가진 양안 녹내장 환자군에서 안축장이 긴 눈과 짧은 눈을 분류하여 녹내장 진행에 영향을 줄 수 있는 여러 전신인자들을 배제하고 안축장이 녹내장 중증도 및 진행속도에 미치는 영향을 비교 분석한 연구이다.
녹내장은 특징적인 시신경의 형태학적 변화와 그에 따른 시야결손을 보이는 진행성 시신경질환으로 안압을 비롯한 여러가지 위험요인들에 의해 진행하는 것으로 알려져 있다. 여러 위험인자 중 근시는 많은 연구들에서 관련성이 입증되었지만, 그와 반대되는 연구 결과들도 보고되어 있다. 따라서 이번 연구에서는 녹내장 진행과 관련된 여러 전신인자들을 배제하고 안축장이 긴 눈(근시안)이 녹내장에 미치는 영향을 알아보기 위해 양안 녹내장 환자군에서 1mm 이상의 안축장 차이를 가진 비대칭 안축장 환자군을 모집하여 개개인의 안축장이 긴 눈과 짧은 눈의 녹내장 중증도와 진행 속도를 비교 분석하였다.
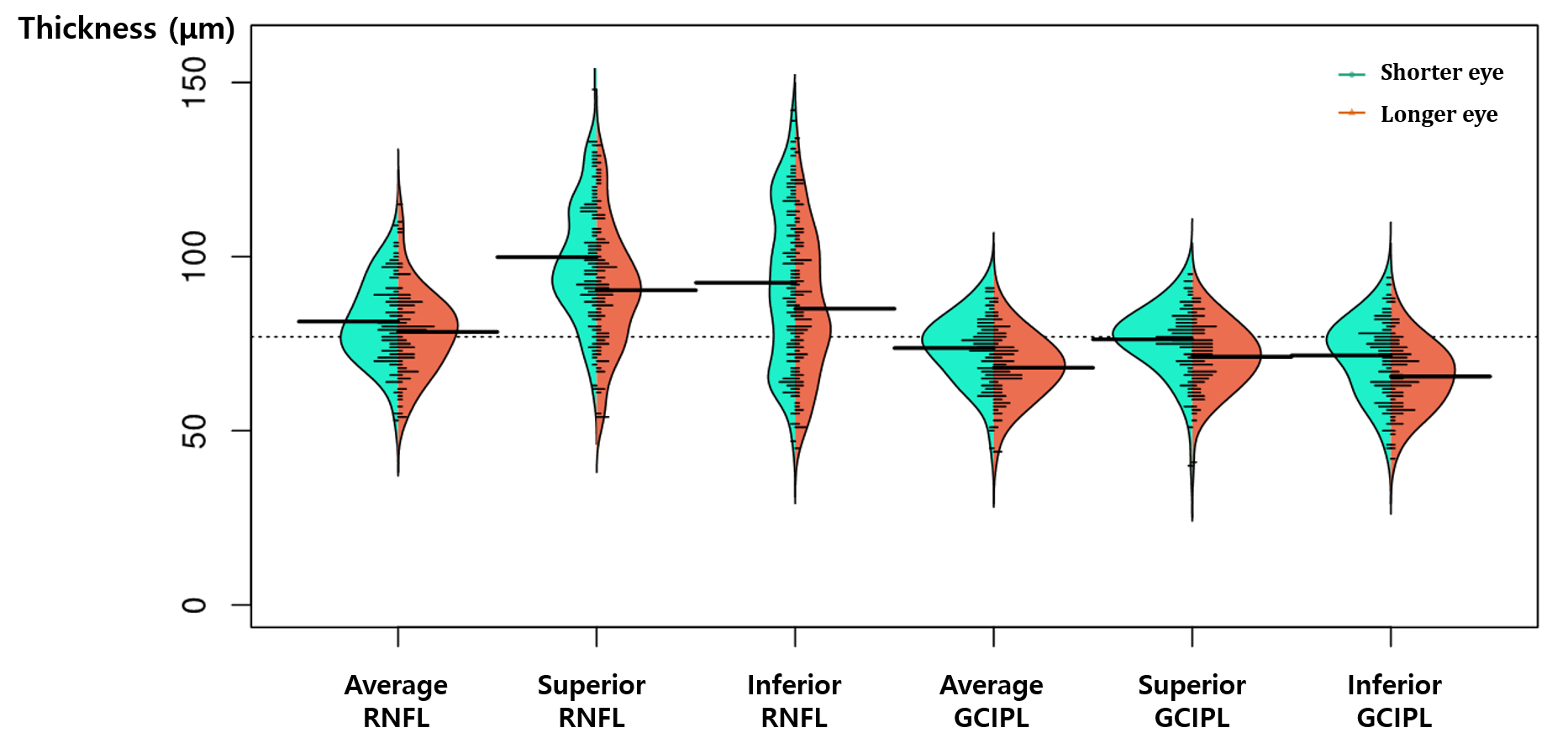
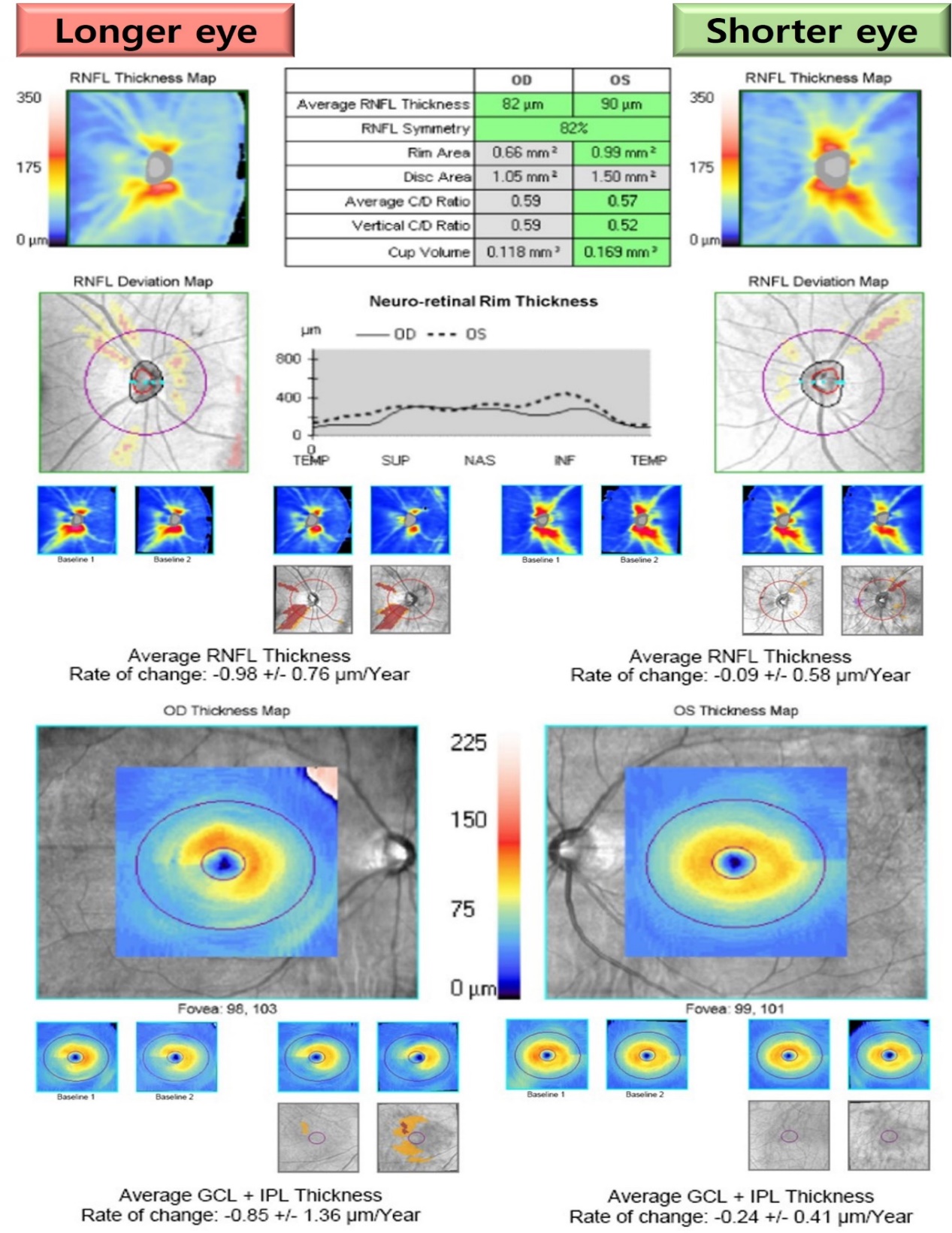
본 연구는 양안의 안축장 차이가 1mm 이상인 양안 녹내장을 진단받은 환자 95명의 190안을 분석하였고, paired t-test, McNemar test 통계분석법을 이용하여 안축장이 긴 눈과 짧은 눈의 단면적인 녹내장 중등도뿐만 아니라 장기간 경과의 녹내장 진행여부 및 진행속도를 비교 분석하였다. 분석 결과, 한 개인에서 안축장이 긴 눈(상대적으로 심한 근시안)이 안축장이 짧은 눈(상대적으로 약한 근시안)보다 시신경의 변화 및 시야결손 정도가 더 빨리 진행되었으며, 장기간의 경과에서 진행속도 또한 안축장이 긴 눈에서 더 빠름을 보여 주었다.
이번 연구는 비교적 적은 비율의 비대칭 안축장을 가진 녹내장 환자군을 모집하여 여러 전신인자들을 배제한 상황에서 근시의 정도가 녹내장 진행에 미치는 영향을 분석한 점에 의의가 있다. 최근 전세계적으로, 특히 우리나라에서, 근시의 유병률이 급격히 증가하고 있는 상황 하에서 녹내장성 시신경 형태의 변화가 근시와 동반되었을 때 주의 깊은 관찰이 필요함을 시사한다.
Profiling protein–protein interactions to predict the efficacy of B-cell-lymphoma-2-homology-3 mimetics for acute myeloid leukaemia
Nature biomedical engineering

(서울대학교병원
혈액종양내과,공동교신저자)

(내과학교실,공동제1저자)

(서울대학교 생명과학부,
공동교신저자)

(서울대학교 생명과학부,
공동제1저자)
급성 골수성 백혈병(AML)은 혈액 또는 골수 내 비정상 백혈구가 급격히 증식하여 정상 혈액 세포의 생성을 방해하는 혈액암의 일종으로, 신속하고 효과적인 치료법의 선택이 매우 중요하다. BH3 모사체는 BCL2 단백질을 표적으로 하여 암세포의 사멸을 유도하는 약물로, 특히 ‘ABT-199(Venetoclax)’ 표적 항암제는 AML 치료에 높은 성과를 보였다. 그러나 모든 환자가 동일한 치료 효과를 얻지 못하고, 일시적 관해 후 저항성이 생기는 경우가 있어 ABT-199의 효과를 미리 예측할 수 있는 방법이 필요했다.
연구팀은 ABT-199가 BCL2 단백질에 선택적으로 결합하여 BCL2-BAX 복합체를 분해시키고, 이 과정에서 활성화된 BAX 단백질이 암세포의 사멸을 유도하는 것을 확인했다. 이를 통해 ABT-199가 암세포를 죽이는 주요 매커니즘을 명확히 밝혀냈다.
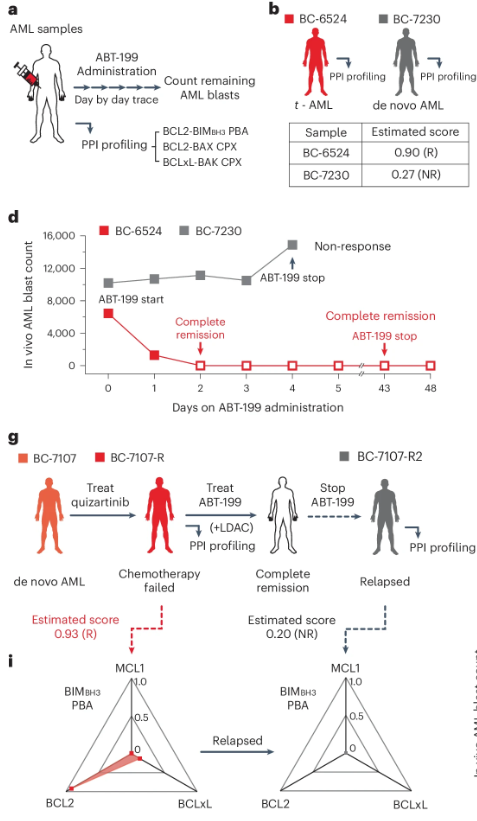
이어 연구팀은 32명의 AML 환자 검체에서 다차원 PPI 프로파일 데이터를 획득하고, 생체 외 수준에서의 약물 반응성과의 상관관계를 분석했다. 그 결과, ABT-199의 민감성(얼마나 잘 듣는지)과 저항성(얼마나 저항하는지)에 영향을 미치는 주요 단백질 복합체를 밝혀냈다. 특히, BCL2-BAX 복합체는 ABT-199의 민감성과, BCLxL-BAK 복합체는 저항성과 관련이 있음을 확인했다.
이 데이터를 바탕으로 연구팀은 개별 AML 환자의 ABT-199 약물 반응성을 예측할 수 있는 ‘고성능 동반진단 바이오마커’를 개발했다. 이 바이오마커는 환자의 세포에서 특정 PPI 신호가 어떻게 변화하는지를 보고, ABT-199가 효과가 있을지를 높은 정확도로 예측할 수 있다.
연구팀은 개발한 바이오마커의 예측 정확도를 생체 외 수준에서 테스트했다. 그 결과, 최대 94%의 예측 정확도(AUC-ROC)를 보였으며, 이는 임상 적용에 충분한 수준이다. 실제 10명의 AML 환자를 대상으로 한 임상 테스트에서도 9명의 항암제 반응성을 성공적으로 예측했으며, 민감도 100%, 특이도 83.3%의 성능을 보였다. 이는 높은 정확도로, 환자의 항암제 반응성을 예측할 수 있음을 확인했다.
이번 연구는 기존에 반응 예측 바이오마커가 부족했던 급성 골수성 백혈병에서 ABT-199(Venetoclax) 요법의 중요성을 부각시키는 의미 있는 성과이며 향후 급성 골수성 백혈병의 정밀의료 발전에 크게 기여할 것으로 기대한다.
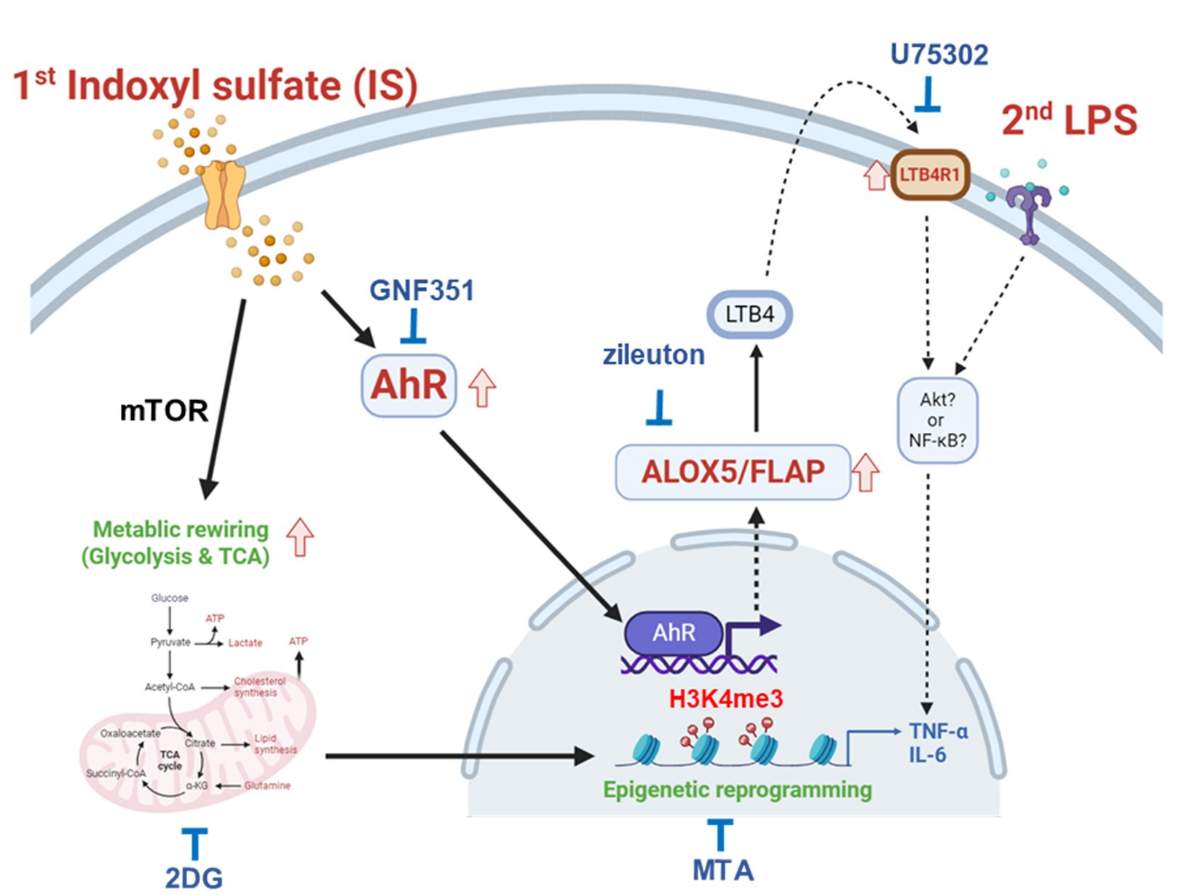
Uremic toxin indoxyl sulfate induces trained immunity via the AhR- dependent arachidonic acid pathway in end-stage renal disease (ESRD)
eLife

(미생물학교실/의과학과,
공동교신저자)

(의학연구원 감염병연구소,
제1저자/공동교신저자)
본 연구는 만성 신장병 환자에서 증가하는 대표적 요독증 독소인 인독실 황산염(indoxyl sulfate)이 선천면역세포에서 훈련면역(trained immunity)을 유도하는 새로운 기전을 규명하였다. 이를 통해 만성 신장병 환자에서 선천면역 세포의 기능장애 유발에 대한 이해를 넓혀주고 새로운 치료 타깃으로의 가능성을 제시한 연구이다.
최근 만성 신장병(chronic kidney disease) 환자 수가 급속히 증가하고 있으며 전 세계적으로 유병률은 8~16%, 약 8.5억 명이 본 질환으로 고통받고 있다. 특히 말기 신장병으로 진행하면 이식 외에는 근본적 치료법이 없고 혈액투석을 통한 지속적인 관리가 유일한 현실적 치료법이다. 말기 신장병 환자의 주요 사망 원인은 심혈관질환과 감염인데 만성 염증반응이 깊이 관여하는 것으로 알려져 있다. 그럼에도 면역기능 장애에 관한 기전 연구는 여전히 제한적이다.
면역학적 기억은 적응면역계의 가장 중요한 특성 중 하나로 주로 T세포와 B세포에서 형성된다고 알려졌다. 하지만 최근 선천면역 세포에도 일정 기간 이상의 자극이 가해졌을 때, 시간이 지난 후에도 그 자극에 대한 효과를 ‘기억’하는 현상이 존재함을 보고하였고 이를 훈련면역(trained immunity)이라 정의하였다.
훈련면역을 주로 미생물 유래의 특정 자극으로 유도된 후 이후 발생하는 다양한 미생물 공격에 대한 방어 기능을 수행하므로 숙주에게 유리한 방어기전으로 생각된다. 하지만 최근 산화된 LDL-콜레스테롤이나 요산과 같은 내재적 염증 유발 물질에 의해 유도되는 경우는 만성 염증반응으로 이어져 숙주에 악영향을 끼칠 가능성이 제시되었다. 이러한 내재적 염증 유발 물질이 비만, 대사증후군이나 고령자에게서 증가하기 때문에 최근 주목받고 있다.
본 연구팀은 말기 신장병에서 체내에 축적되는 인독실 황산염이 인간 단핵구에 훈련면역을 유도하고, 이는 aryl hydrocarbon receptor에 의존적인 아라키돈산(archidonic acid) 경로에 의해 조절됨을 분자 면역학 실험기법과 동물모델로 입증하여 새로운 염증반응 유발 기전 및 치료 타깃으로의 가능성을 제시하였다.
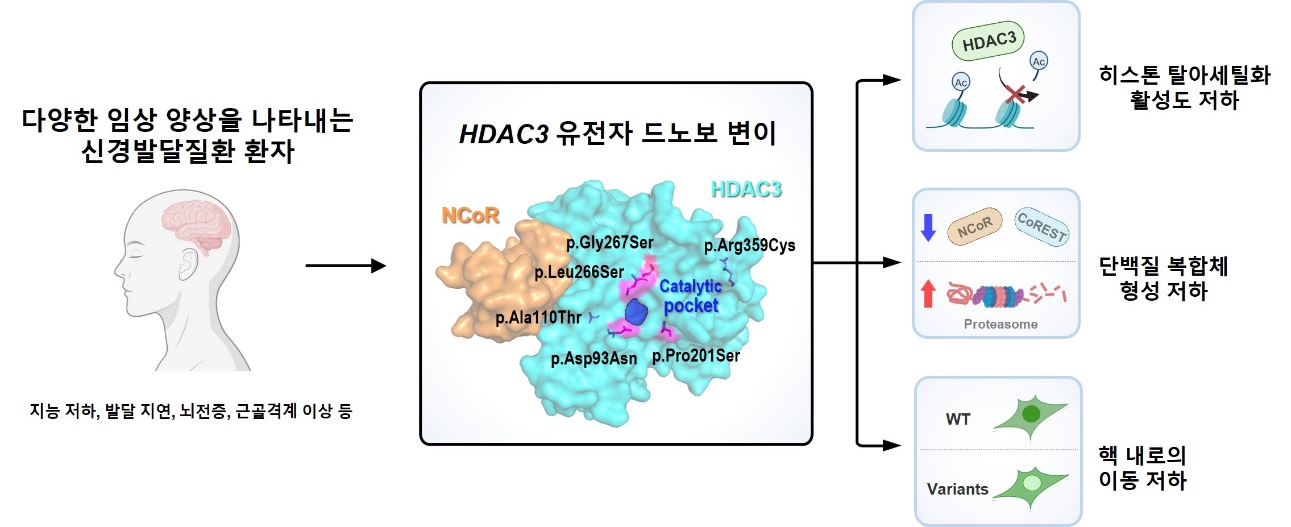
De novo missense variants in HDAC3 leading to epigenetic machinery dysfunction are associated with a variable neurodevelopmental disorder
The American Journal of Human Genetics

(약리학교실,공동교신저자)

(소아과학교실,공동교신저자)

(약리학교실,공동제1저자)

(서울대병원 임상유전체
의학과/현 강남세브란스병원
진단검사의학과,공동제1저자)
본 연구는 지난 10년간 서울대어린이병원 희귀질환 센터를 방문한 2,510명의 환자를 대상으로 진행되었다. 연구의 목적은 원인을 알 수 없는 복합 발달질환 환자들에게서 새롭게 원인 유전자를 발굴하는 것이었다. 환자와 부모를 대상으로 시행한 전장 엑솜 시퀀싱(whole-exome sequencing) 데이터를 재분석한 결과, 히스톤 탈아세틸화 효소 3(Histone Deacetylase 3, HDAC3) 유전자에서 2가지의 신생 돌연변이(de novo 변이: 부모에게 존재하지 않고 자녀에게 새롭게 발생한 변이)가 2명의 사례에서 확인되었다. 인간에게는 총 18종류의 히스톤 탈아세틸화 효소(HDAC)가 존재하며, 이 중 4번과 8번(HDAC4, HDAC8) 효소의 이상은 기존의 유전질환 발생과 관련이 있는 것으로 알려져 있다. 그러나 다른 효소들의 이상과 유전질환 발생의 연관성은 아직 밝혀지지 않았다. 본 연구는 국⸱내외 협력 네트워크를 통해 국내 2명의 사례 외에 영국과 미국에서 4명의 추가 사례를 발굴하여, 최종적으로 6명의 환자에서 HDAC3 유전자의 6가지의 신생 돌연변이를 확인하였다. 연구진은 해당 환자들의 임상 양상을 종합적으로 분석하고, 시험관 내 실험, 세포 실험, 단백체 분석을 통해 이 유전 변이들이 HDAC3의 히스톤 탈아세틸화 활성도 저하(66%), 단백질 복합체 형성 저하(100%), 핵 내로의 이동 저하(75%)와 같이 다양한 유전자 기능에 영향을 미친다는 사실을 입증하였다. 이를 통해 HDAC3 유전자의 신생 돌연변이가 신경발달질환의 다양한 증상을 일으키는 신경발달 유전질환과 관련이 있음을 최초로 새롭게 밝혀냈다. 본 연구를 통해 새로운 희귀 유전질환의 원인 유전자를 발굴함으로써, 원인을 알 수 없던 많은 신경발달질환 환자들에게 새로운 유전자 진단의 기회를 제공할 수 있을 것으로 기대된다. 또한, HDAC3 유전자의 기능이 신경발달질환의 발생과 연관이 있음을 확인하여 이를 활용한 약물 치료제 타겟을 발굴한 데 중요한 의의가 있다. 후속 연구에서는 환자들에서 나타난 다양한 임상 양상에 대한 질환 모델링 및 후성유전학적 변화를 살펴보아, 치료제 개발에 이를 수 있는 토대를 마련하고자 계획하고 있다.
논문링크 : https://www.cell.com/ajhg/fulltext/S0002-9297(24)00217-9

