[연구동향]
Serum amyloid A expression in liver promotes synovial macrophage activation and chronic arthritis via NFAT5
Journal of Clinical Investigation

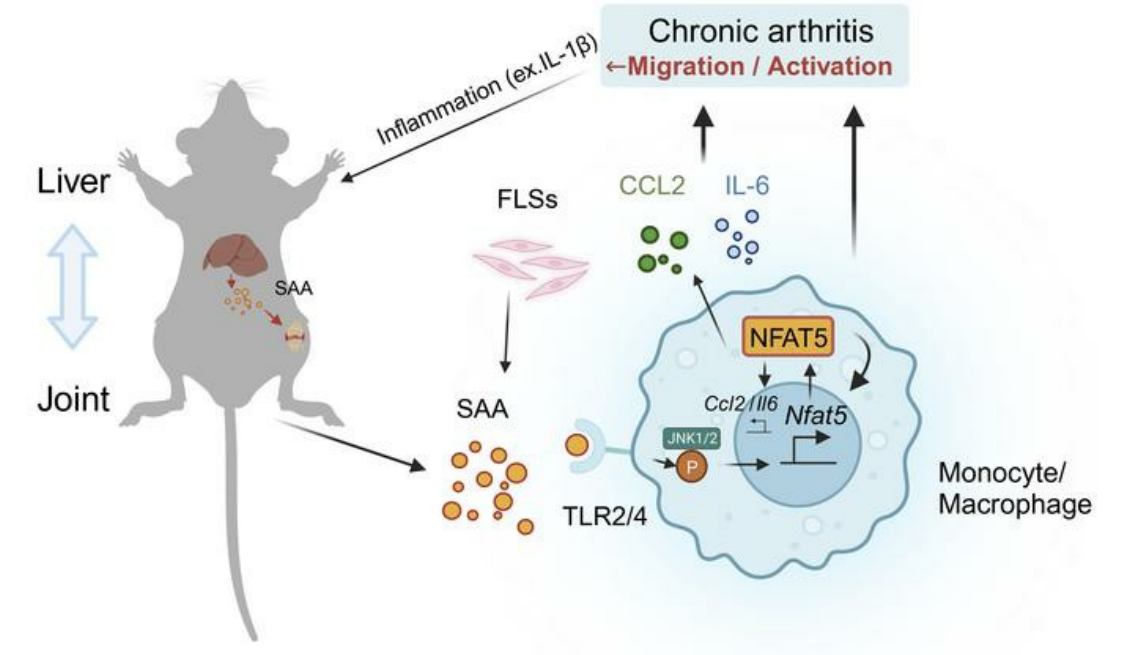
이번 연구는 가톨릭대학교 의과대학 창의시스템의학연구센터 김완욱 교수 연구팀과 공동으로 수행한 연구로, 간에서 생성되는 혈장 아밀로이드 A(serum amyloid A, SAA)가 무릎 관절내 대식세포의 NFAT5 발현과 활성화를 촉진하여 관절염 진행을 가속시킨다는 것을 증명함으로써 서로 다른 장기인 간과 관절 사이의 상호작용의 중요성을 밝힌 연구이다.
NFAT5라는 전사인자는 세포 외부 삼투압으로부터 세포를 보호하는 역할을 하는 유전자들의 발현을 높이는 역할을 하는 것으로 알려져 있는데, 가톨릭대학교 김완욱 교수 연구팀에서 이전에도 해당 전사인자가 만성 관절염 발병에도 중요한 역할을 한다는 것을 보고한 바가 있다. 본 연구에서는 혈장 아밀로이드 A라고 하는 급성 염증 상황에서 간에서 많이 생산된다고 알려진 급성 단계 단백질(acute phase protein)이 대식 세포를 자극하여 NFAT5 발현과 활성을 증가시킨다는 결과를 시발점으로 하여, 다양한 세포 실험과 동물 모델 실험을 통해 간이 생성하는 혈장 아밀로이드 A에 의한 NFAT5의 발현 및 활성화 증가가 관절 염증을 가속화시킨다는 것을 밝혔다. 또한 해당 과정에는 TLR2/4 수용체를 통한 SAA의 인지와 세포내 JNK 신호 전달이 NFAT5의 발현과 활성화에 중요하다는 것을 밝혔으며, 이로 인한 CCL2 발현 증가가 특히 관절염 증세 악화에 중요함을 밝혔다.
더불어 실제 류마티스 관절염 환자의 혈액 샘플에서도 SAA의 양은 DAS28 수치와 양의 상관관계를 가지고 있음을 보였으며, 관절염 치료 반응이 좋았던 환자는 SAA 수치도 유의미하게 낮아짐을 보임으로써 임상적으로도 SAA의 분비가 관절염 증세에 영향을 미치고 있음을 보여주었다.
이러한 결과는 우리 몸의 면역 체계에 있어 인체 내 멀리 떨어진 간과 관절 사이에 상호작용에 대한 새로운 이해를 제공한 한가지 예로, 인체에서 벌어지는 다양한 상황이나 질환 발병에 장기간 커뮤니케이션(organ-to-organ communication)에 대한 이해가 필요함을 증명한 결과라 할 수 있다.
이번 연구는 가톨릭대학교 창의시스템의학연구센터와 함께 한 연구로 임상 샘플을 통해 가설을 세우고 세포 실험 및 전임상 연구를 통해 가설을 증명하며 다시 임상 샘플 분석을 통해 해당 결과의 임상적인 의미를 뒷받침하는 선순환 구조가 우수한 연구결과로 이어질 수 있음을 보여주는 사례라고 할 수 있다.
Subsequent correlated changes in complement component 3 and amyloid beta oligomers in the blood of patients with Alzheimer's disease
Alzheimer's & Dementia

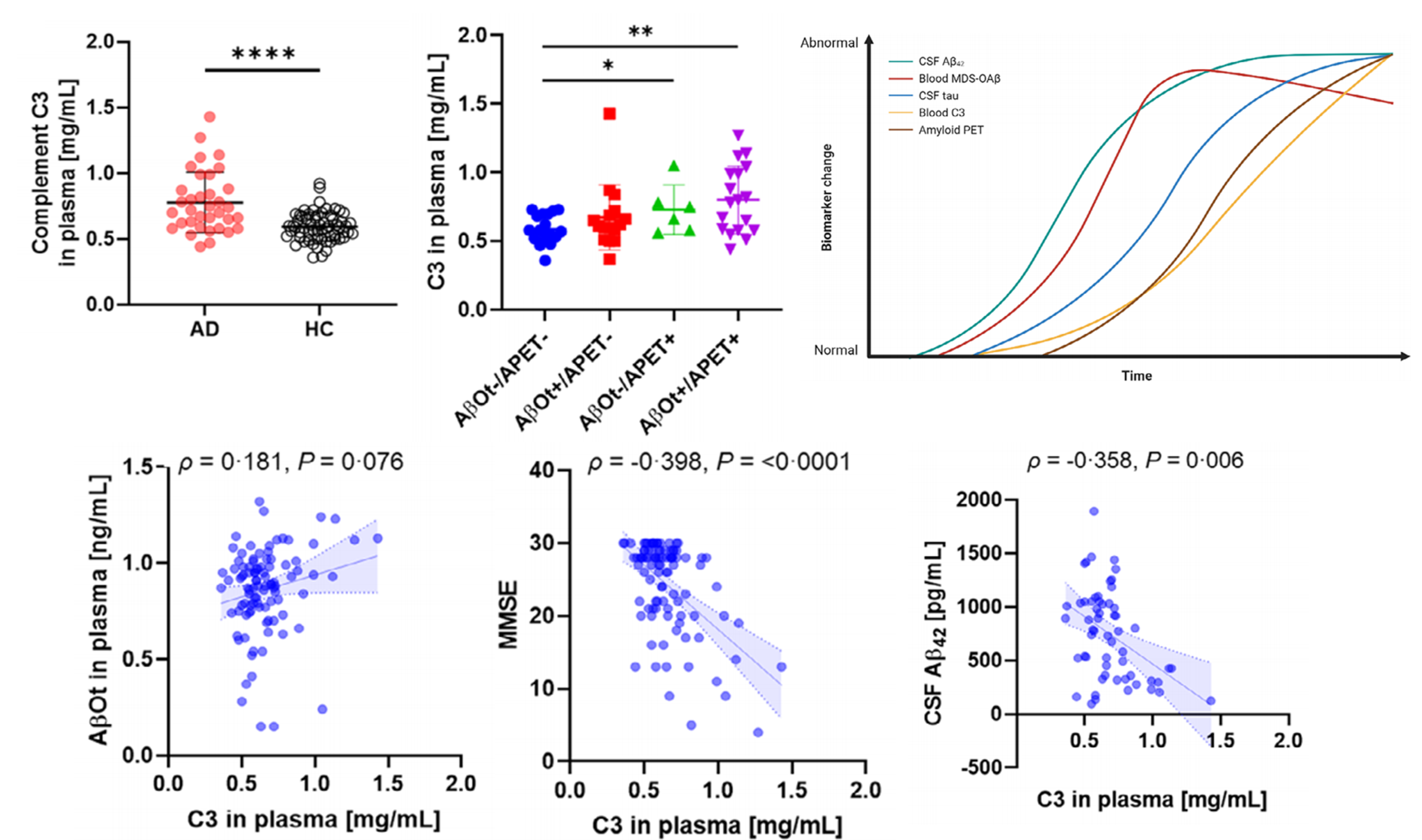
본 연구는 알츠하이머병(Alzheimer's disease, AD) 환자의 혈액에서 관찰되는 보체 면역계의 complement component 3 (C3)과 아밀로이드 베타 올리고머화(Aβ oligomerization, AβOt)의 상호 연관성을 국내외 저명 연구자들 및 병원들과 공동연구를 통하여 얻은 결과이다. 참여 연구자들은 서울대학교 의과대학 신경과 김상윤/박영호 교수 연구팀, 가천대학교 안성수 교수 연구팀, 중앙대학교병원 신경과 윤영철 교수, 경북대학교 칠곡병원 신경과 이호원/석경호 교수 연구팀, 동아대학교병원 박경원 교수, 보훈병원 강민주 교수팀 및 스웨덴 예테보리 대학 Henrik Zetterberg 교수의 공동연구로 진행되었다.
혈액 C3는 AD 환자와 뇌척수액 또는 아밀로이드 PET 양성 그룹에서 증가하여, amyloid pathology가 진행됨에 따라 증가하는 것을 확인하였다. 또한, 혈액 C3는 AβOt와 약한 양의 상관관계가 발견되었으며, 뇌척수액 Aβ42 및 인지 성능과 강한 음의 상관관계를 나타냈다. 이러한 상관관계는 AD에서 혈액 C3의 증가가 Aβ와 밀접한 연관성을 가지고 있음을 뒷받침한다. 다른 바이오마커의 진단 일치도에 따라 그룹을 분류하여 바이오마커의 변화를 조사한 결과, 혈액 AβOt와 뇌척수액 Aβ42의 변화가 가장 먼저 나타났으며, 이어서 혈액 C3 변화에 이상이 관찰되었다. 이러한 바이오마커의 시간적 변화는 뇌척수액과 혈액에서 Aβ의 변화가 우선적으로 일어난 뒤에 혈액 C3가 뒤따라 증가하였다. AD에서 증가된 혈액 C3는 amyloid pathology와 연관되어 있으며, 혈액 내에 존재하는 Aβ를 제거하기 위한 몸의 면역 반응을 반영할 수 있다. Aβ 결합 단백질에 대한 추가 연구는 혈액 내 Aβ 메커니즘에 대한 이해를 높일 것이다.
이러한 연구 결과는 알츠하이머병에서 혈액 내 보체 면역계 시스템의 역할에 대한 이해를 증가시키고, 질병의 조기 진단 및 치료에 대한 새로운 접근법을 제안할 수 있다. 또한, 혈액 내에 C3를 포함한 보체 성분 검사 및 AβOt 혈액검사를 병행할 경우 비침습적이고 비용 효율적인 진단 도구로의 활용 가능성을 제시하였다. 혈액에서 amyloid pathology와 신경염증을 동시에 측정함으로써 환자에게 좀 더 정확한 진단과 치료가 가능할 것이라 기대하고 있다. 최근, 보체 시스템에 의한 신약들의 부작용이 증가함에 따라 혈액 C3의 측정은 진단과 함께 환자의 치료 후 스크리닝에 대한 새로운 획기적인 방법을 탐구하는 데 있어서 중요한 기여를 할 수 있을 것이다.
((주)피플바이오에서 알츠하이머 혈액검사 키트인 알츠온(AlzOn)을 제공하였기에 감사하는 바이다.)
PCSK9 stimulates Syk, PKCδ, and NF-κB, leading to atherosclerosis progression independently of LDL receptor
Nature communications

(내과학교실,교신저자)

(서울대학교병원 의생명연구원,
교신저자)

(서울대학교병원 심혈관연구단,
제1저자)

(서울대학교 융합과학대학원
MMBS,제1저자)
PCSK9(Proprotein Convertase Subilisin/Kexin type 9)은 간세포에서 만들어져서 세포 외로 분비되는데, LDL-수용체와 결합하여 수용체를 파괴시켜 혈중 LDL-C를 제거하지 못하게 만드는 나쁜 단백질이다. 그리하여 PCSK9을 억제하여 LDL-수용체의 파괴를 방지하고 수용체 수를 늘려서 혈중 LDL-C를 낮추는 항체가 개발되었는데, 에볼로큐맵과 알리로큐맵이 그것이다. 현재 블록버스터 약으로서 암젠과 사노피사가 엄청난 매출을 올리고 있다.
<2> 세계 최초로 PCSK9 단백질의 2중 작용을 발견하다.
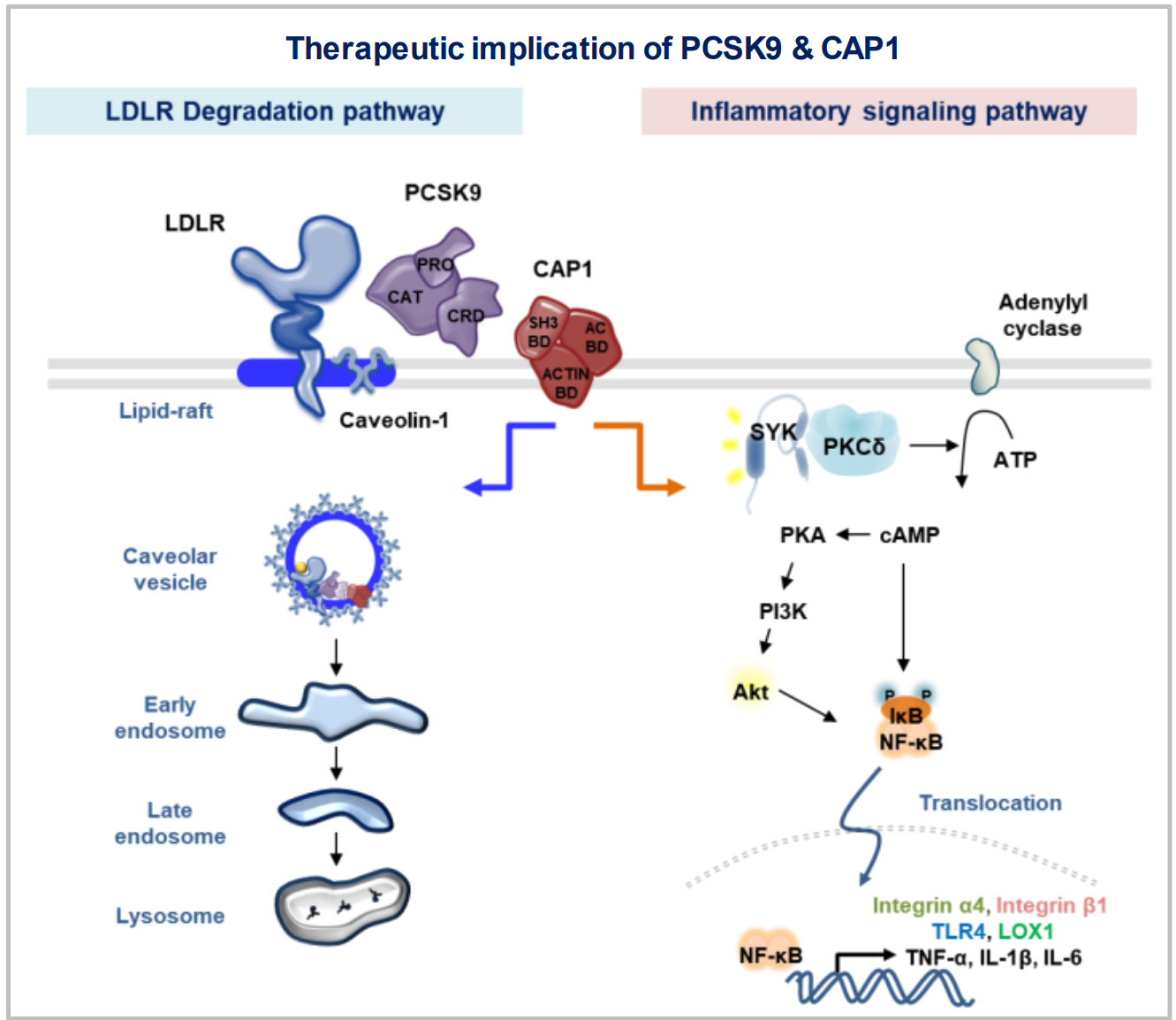
이처럼 콜레스테롤을 올리는 것으로만 알려진 PCSK9 단백질이, 콜레스테롤과는 별개로 또 다른 나쁜 효과를 발휘한다는 것을 세계 최초로 규명하였다. 김효수 교수팀은, 4년전 PCSK9이 LDL-수용체를 파괴시키는데 CAP1 단백질이 필수적이라는 사실을 발견하고 그 기전을 규명한 바 있다. 본 연구에서 PCSK9이 단핵구의 표면에 CAP1과 결합하여 신호전달 경로인 PKC/SYK/NFkB를 통해서 단핵구를 흥분시켜 염증을 유발하며 그 결과 죽상경화증이 악화됨을 밝혀, PCSK9 억제제 개발의 새로운 방향을 제시했다.
쥐의 죽상경화증 모델을 확립하고, PCSK9을 과발현하는 바이러스를 정맥 주사한 쥐는 죽상경화증이 악화된다는 것을 발견했다. 그런데 흥미로운 사실은, LDL-수용체가 없는 쥐에서도 PCSK9 바이러스를 주입하면 죽상경화증이 악화된다는 것이었다. 즉, PCSK9이 LDL-수용체를 파괴시켜서 해악을 끼친다는 기왕에 알려진 기전과는 무관한, 새로운 기전을 통해서 죽상경화증을 악화시킨다는 것을 시사한다. 세포실험으로 PCSK9이 단핵구 표면의 CAP1과 결합하여 단핵구를 흥분시켜서 염증이 유발되어 죽상경화증이 악화됨을 밝혔으며, 동물실험에서 PCSK9 바이러스 주입에 의해서 악화되는 죽상경화증이 CAP1 결손쥐에서는 재현되지 않음을 증명하였다.
<3> PCSK9 단백질의 2중 작용 차단제 신약 개발
본 연구진은 신치료제 개발을 위한 중요한 실험을 수행하였는데, PCSK9과 CAP1의 결합을 차단하는 Fc-CAP1을 제작하여 성능을 검증하였다. 인간 세포를 이용한 실험에서 Fc-CAP1은 PCSK9과 CAP1의 결합을 차단하여 단핵구가 흥분하는 것을 막았으며, 그 효과는 PCSK9 차단 항체인 에볼로큐맵에 비해서 우월함을 증명했다. 인체 적용가능성 확인을 위해, 관동맥질환 환자와 정상인의 혈액과 단핵구를 분석한 결과, PCSK9 혈중 농도와 단핵구의 염증유도 활성이 비례함을 증명했다.
현재 절찬리에 시판되고 있는 PCSK9 억제항체인 레파타 (에볼로큐맵) 피하주사제는, 2가지 기전 중에서 한 가지인 LDL-수용체를 살려서 콜레스테롤을 낮추는 효과만 있으며, 염증을 통제하는 효과는 없는 것으로 드러났다. 이에 반해 본 연구진이 개발하고 있는 차단제는 PCSK9-CAP1 사이의 결합을 차단하여, (1) 간세포 표면의 LDL-수용체를 살려서 콜레스테롤을 낮추는 효과도 발휘하면서, (2) 단핵구의 활성화와 염증을 막아 죽상경화증을 예방하는, 2중 효과를 발휘한다.
이번 연구의 결과 논문은 국제학술지 Nature의 자매지인 Nature Communications, IF;16.6에 게재되어 온라인상으로 세계에 발표되었다. 이번 연구는 범부처 국가신약개발사업단 (KDDF), 한국연구재단의 혁신신약 기초기반기술사업, 보건부의 연구중심병원 육성 R&D 유니트의 지원으로 이루어졌다.

PCSK9과 CAP1의 결합에 의해 PKCδ와 Syk가 활성화되고 뒤이어서 여러 신호전달체계가 활성화된다. 궁극적으로 단핵구가 흥분하게 되며 인체에 염증을 유발한다.
1) 좌측은 기존에 알려진 ‘콜레스테롤을 높이는 나쁜 작용’의 기전을 서술함
LDL-수용체와 PCSK9과 CAP1이 3중 결합을 하면, CAP1의 인도에 의해서 삼량체가 카베오좀을 통해서 세포내로 유입되어 LDL-수용체가 파괴된다. 그 결과, 혈중 콜레스테롤을 간세포내로 유입시키는 관문인 LDL-수용체가 세포표면에서 줄어들게 되어, 혈중콜레스테롤치가 올라가게 된다.
2) 우측은 이번에 새로 밝힌 ‘염증을 유발하는 나쁜 작용’의 기전을 서술함.
LDL-수용체와 PCSK9과 CAP1이 3중 결합을 하면, CAP1의 신호전달 기능에 의해서 하부 PKCδ와 SYK이 활성화되면서 하부의 다수 신호전달 단백질들을 활성화시킨다. 그 결과 단핵구가 흥분하면서 죽상경화증 등 대사질환을 유발하게 된다.
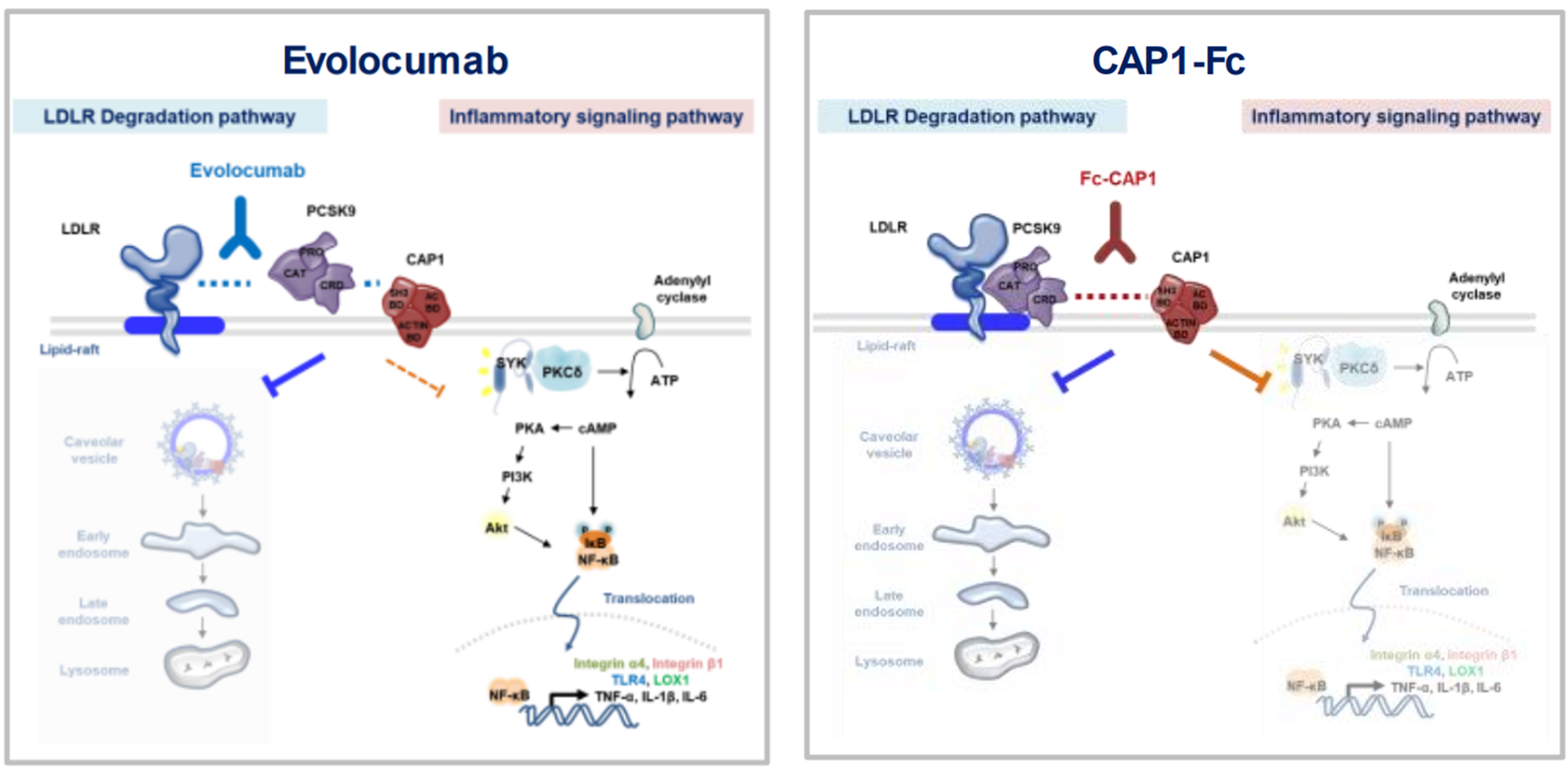
1) 좌측은 이미 시판 중인 레파타의 1중 차단 효과를 서술함. 레파타는 PCSK9에 붙는 항체로서 LDL-수용체와의 결합을 방해함으로써 LDL-수용체 파괴를 예방해서 혈중 콜레스테롤을 낮춘다. 그러나, PCSK9-CAP1 결합은 방해를 하지 못하기에, PCSK9에 의한 염증 유발 기전은 그대로 살아남게 된다.
2) 우측은 개발 중인 신치료제의 2중 차단 효과를 서술함. 개발하고 있는 신치료제(예를 들면 Fc-CAP1)는, PCSK9-CAP1 결합을 차단하기 때문에, LDL-수용체 파괴도 막으면서 염증유발 기전도 차단할 수 있다.
Genome-wide interaction study of dietary intake and colorectal cancer risk in the UK Biobank
JAMA Network Open

(예방의학교실,교신저자)

(예방의학교실,제1저자)
본 연구는 UK Biobank의 식이섭취와 대장암 위험에 대한 유전체 전반의 상호작용에 대해 연구한 내용이다. 연구자료로는 UK Biobank의 전향적 코호트에 참여한 대상자 중 백인 참가자들의 자료를 활용했다. 연구대상자들은 2006년 3월 13일부터 2010년 10월 1일까지 모집되었고, 2021년 6월 25일까지 사망 또는 암 발생을 추적했다. 기반 조사 이전 1년 동안의 11가지 식이 요인의 평균 섭취 빈도를 터치스크린 설문지를 통해 얻었다. 9300만 개 이상의 유전적 데이터 변이 중 품질 관리를 거친 4,122,345개의 변이가 분석에 포함되었다. 대장암 발생은 연계된 암 통계를 이용하여 세계보건기구의 국제질병분류 제10판에 따라 정의하였다. 전장유전체 상호작용 분석에는 조건부 로지스틱 회귀 모델을 사용하여 식이 요인과 변이 사이의 상호작용을 평가하였다. 단일 염기 다형성 수준의 전장유전체 상호작용으로부터 얻은 요약 통계량은 유전자 기반 분석에서의 상호작용에 대한 통계적인 추정 P값을 계산하는 데 사용되었다.
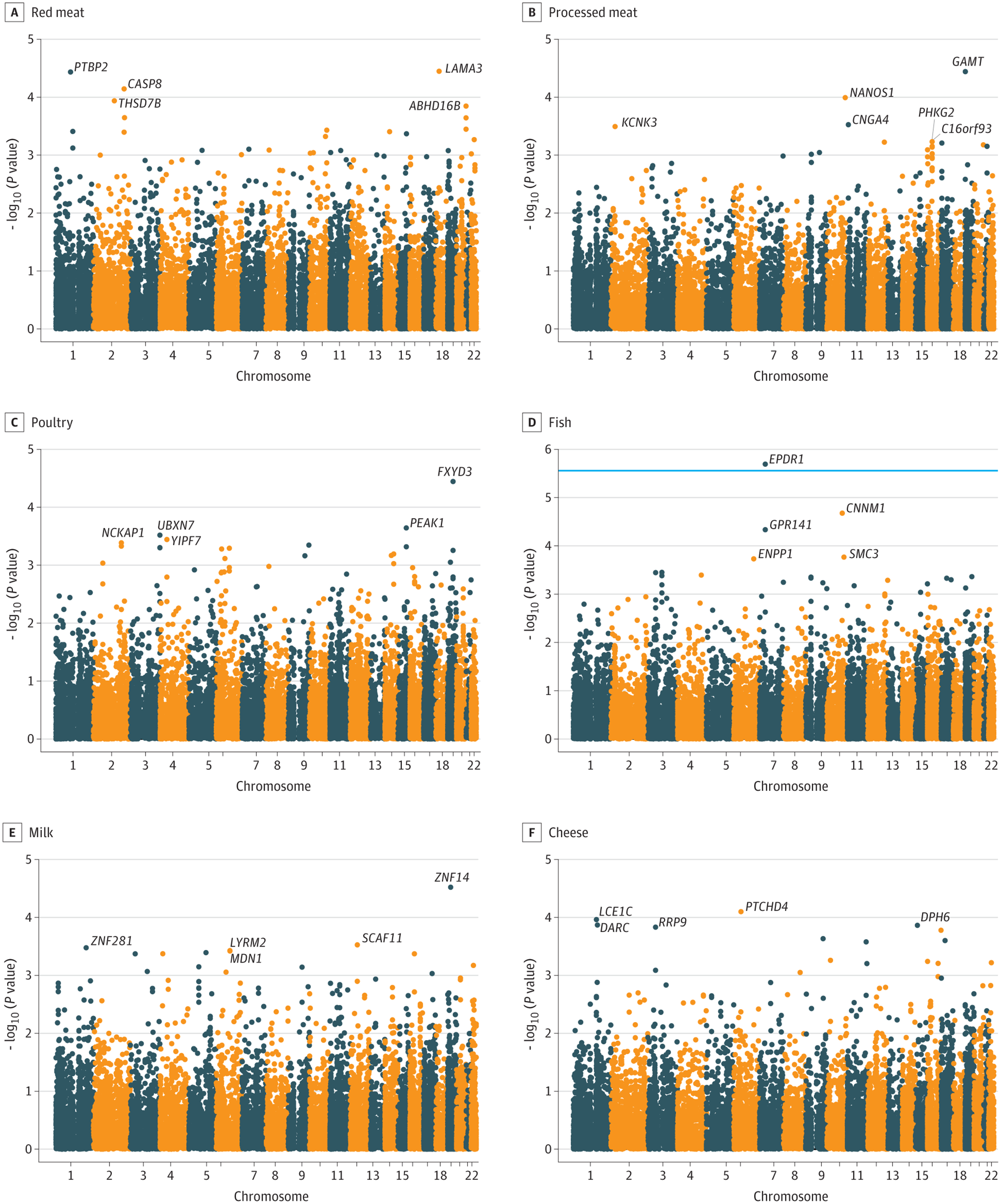
총 4,686명의 참가자가 대장암 진단을 받았으며, 추적 관찰 기간 중앙값은 12.4년이었다. 대장암환자 1명 당 3명의 대조군을 짝지어 총 14,058명의 대조군을 선정하였다. 총 324개의 변이가 식이 섭취와의 상호작용에서 제안된 유의확률의 임계값(P < 1 × 10−5)에서 확인되었다. 유전자 기반 분석에서, 다수의 EPDR1 유전자 변이가 대장암 위험과 관련하여 생선 섭취와 상호작용하는 것으로 나타났다. 또한, 유전자 세트 풍부도 분석에서는 우유, 치즈, 차, 알코올 섭취와 상호작용하는 특정 기능과 경로로 과다 발현된 단백질 암호화 유전자 세트가 발견되었다.
본 연구에서 생선 섭취와 관련된 대장암 위험은 EPDR1 유전자의 다수의 단일염기 다형성에 의해 수정됨을 확인하였다. 이러한 결과를 통해 우유, 치즈, 차, 알코올 섭취가 대장암 발생과 연결될 수 있는 가능한 기능과 경로를 추가로 제안할 수 있다.
논문링크 : https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2815473
Antibiotic-induced intestinal microbiota depletion can attenuate the acute kidney injury to chronic kidney disease transition via NADPH oxidase 2 and trimethylamine-N-oxide inhibition
Kidney International

(내과학교실,교신저자)

(서울대학교 의학연구원,교신저자)

(보라매병원,제1저자)
의과대학 내과학교실 이정표 교수 연구팀이 한국기초과학지원연구원 황금숙 박사-서울대학교병원 의학연구혁신센터 양승희 교수팀과의 공동연구를 통해 장내 미생물에 의해 생성되는 TMAO 및 이에 의한 산화성 손상이 급성신손상 이후 발생하는 만성콩팥병의 주요한 원인으로 작용하며 이를 효과적으로 조절하여 질병을 호전시킬 수 있음을 규명하였다고 밝혔다. 범부처재생의료기술개발사업단의 지원을 받아 수행한 이번 연구 성과는 신장학 연구분야 최고 국제학술지인 「Kidney International」에 게재되었다.
콩팥병 환자의 예후를 개선하기 위해서는 급성신손상 이후 만성콩팥병으로의 전환을 예방하고 적절히 치료하는 것이 매우 중요하나 아직 그 병태생리학적 요인과 치료방법에 대한 연구가 부족하다. 장내 미생물과 그 대사체는 염증 반응 및 산화성 손상과 관련되어 심혈관질환의 발생과 악화에 관여할 수 있음이 알려져 있으며 신장 질환의 예후에도 유의한 영향을 미칠 수 있을 것으로 주목받고 있다. 연구자는 급성콩팥병 동물 및 세포모델과 중환자실 코호트의 인체자원을 활용하여 급성콩팥병의 예후와 관련된 대사체를 찾고, 항생제를 이용하여 대사체 생성을 감소시켜 신장섬유화를 완화시키며, 대사체에 의한 신장섬유화 발생을 매개하는 산화성손상의 기전적 역할을 규명하고자 연구를 수행하였다.
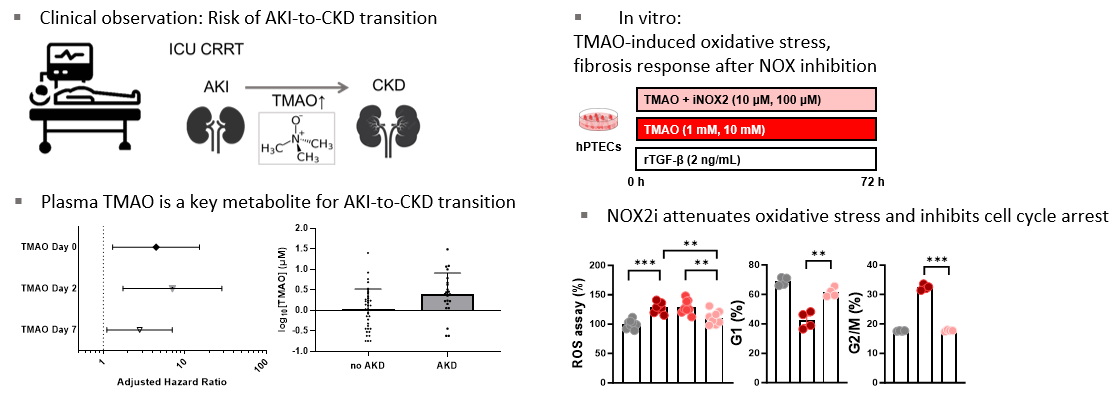
급성신손상으로 지속성 신대체요법을 시행받은 환자의 혈장을 이용한 전향적 대사체 분석 결과 TMAO 농도의 상승이 3개월째 콩팥(신장)기능 악화와 유의한 관련성이 있음을 확인하였다. TMAO를 신장세뇨관세포에 처치하였을 때 활성산소의 증가와 함께 신장세포 섬유화 반응이 유도 되는 것을 확인하였다. 이후 활성산소 생성인자 억제제(NADPH oxidase 2 inhibitor, NOX2i)를 처리하였을 때 활성산소의 생성이 줄어들고 TMAO에 의한 세포의 섬유화, 세포 사멸, 염증반응을 억제하며 세포주기를 활성화시키는 효과를 확인하였다.
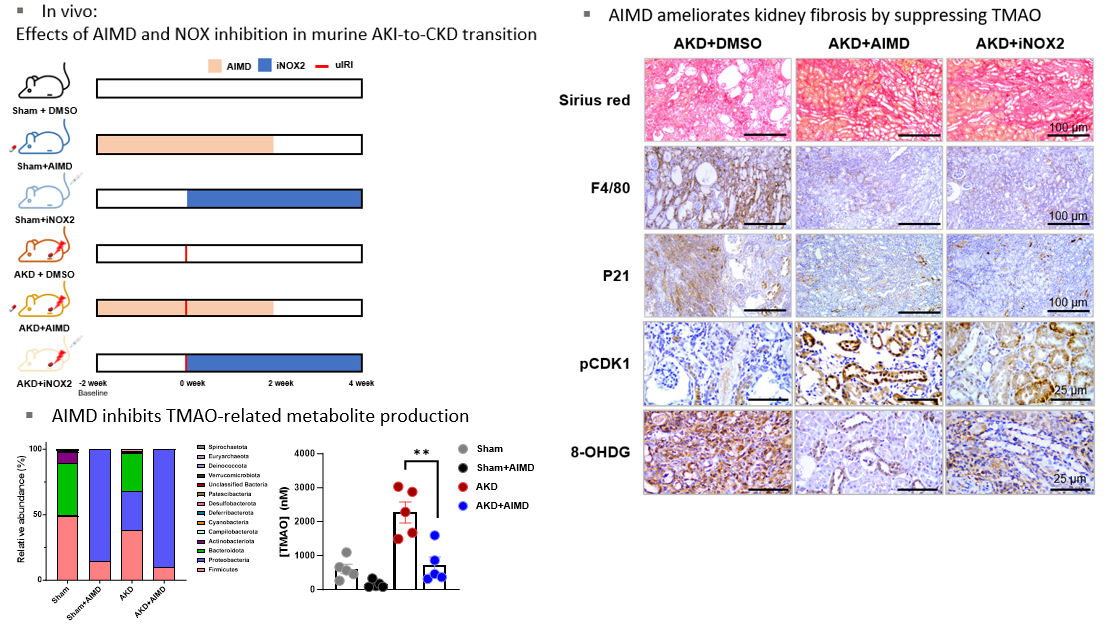
일측 신장동맥결찰을 통한 마우스 급성신손상-만성콩팥병 이행 모델에서 TMAO의 생성의 증가와 함께 신장조직의 손상, 산화성 손상, 조직 염증, 세포사멸 등이 유의하게 증가됨을 확인하였고, 4가지 광범위 항생제를 마우스에 투여하여 장내 미생물 변화를 유도하였을 때 TMAO 생성과 관련된 장내 미생물의 감소와 함께 TMAO의 농도 상승을 억제할 수 있었다. 장내 미생물 조절을 통한 TMAO 생성 억제는 신장조직의 손상, 산화성 손상, 조직 염증, 세포사멸 등의 반응을 유의하게 호전시켰으며, NOX2i를 처리하였을 때에도 신장 조직의 손상, 산화성 손상, 조직 염증, 세포사멸 및 신장 섬유화를 호전시킬 수 있음을 확인하였다.
이 연구의 공동 1저자인 서울특별시보라매병원 이정환 교수는 “이번 연구는 장내 미생물에 의해 생성되는 TMAO 대사체가 급성콩팥병 이후 발생하는 만성콩팥병 및 신장섬유화의 주요한 원인이며 TMAO 및 이와 관련된 산화성 손상을 줄여서 신장질환의 예후를 개선시킬 수 있음을 밝힌 것”이라며, “다양한 신장질환에서 장내 미생물 조절이나 산화성 손상의 억제를 통해 난치성 신장질환의 예방 및 치료 가능성을 제시할 수 있었다”고 연구의 의의를 설명했다. 신장질환 특이적인 치료약제가 부족한 상황에서 이번 연구는 급성신손상 이후 만성콩팥병으로 진행을 매개하는 TMAO 대사체와 이를 통해 유도되는 산화성 손상의 역할을 확인하고, 장내 미생물 조절이나 활성산소 생성인자 억제제 등 효과적인 치료 방법을 제안했다는 점에서 급성콩팥병 및 신장섬유화 기전 및 치료 연구에 중요한 진전으로 평가된다.
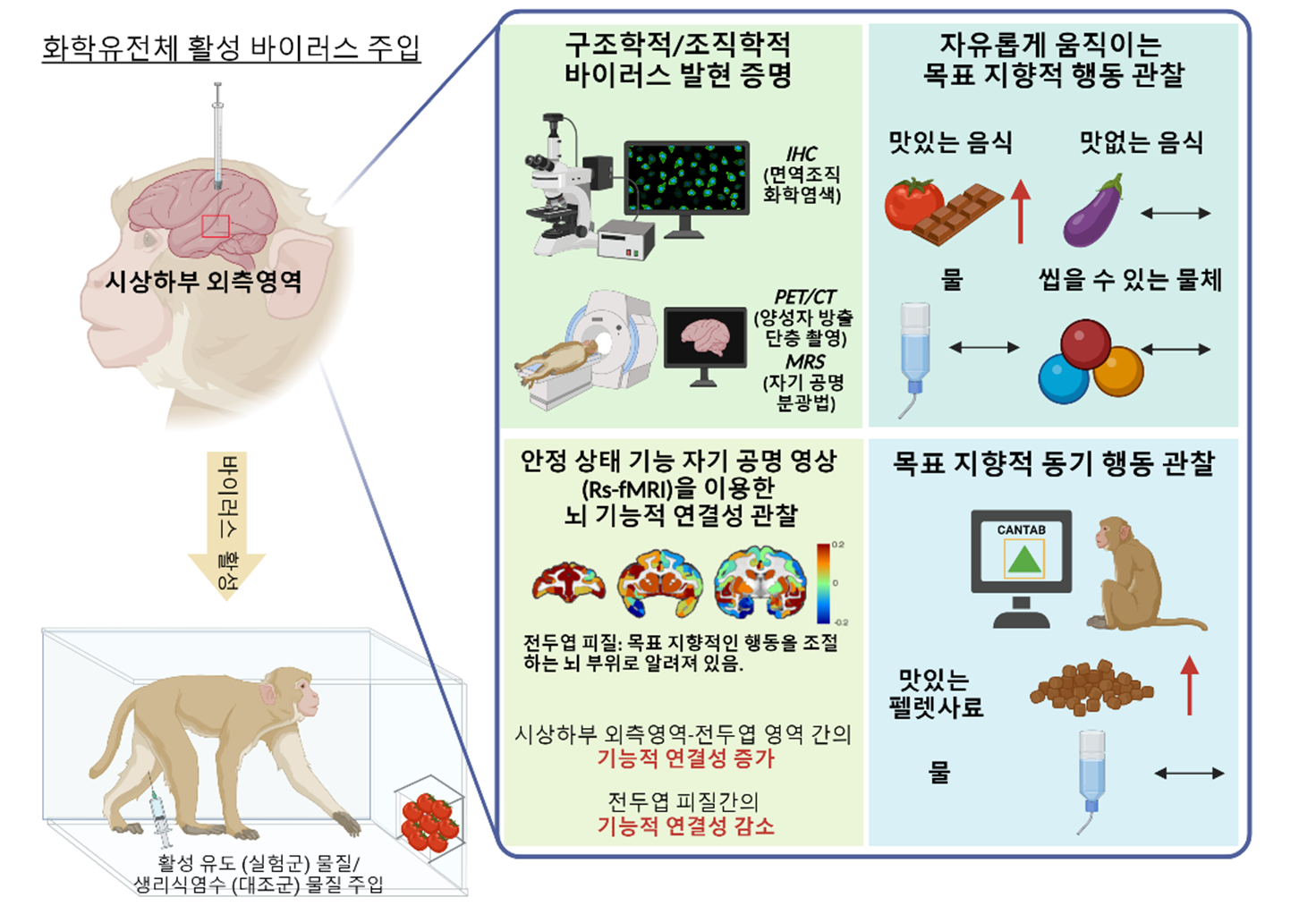
Hypothalamic neuronal activation in non-human primates drives naturalistic goal-directed eating behavior
Neuron, 2024

(의과학과/뇌인지과학과,
교신저자)

(의과학과,제1저자)

(의학과2학년,제1저자)
과학 연구관련 세계적인 탑 SCI 저널인 ‘Neuron (IF = 16.2)’에 서울대학교 의과학과/뇌인지과학과 최형진 교수, 한국생명공학연구원 국가영장류센터 이영전박사, 한국기초과학지원연구원 조지현 박사, 한국원자력의학원 최재용 박사 연구팀의 공동연구를 발표하였다.
시상하부의 억제성신경을 활성화하면, 원숭이가 맛있어하는 음식을 갈구하는 행동이 증가됨을 확인하였다. 이는 비만이 유발되는 가장 큰 원인인 선호하는 음식에 대한 중독성을 시상하부 억제성신경이 담당한다는 것을 증명한다. 이 실험에서는 화학물질을 활용하여 특정 신경을 활성화시키는 화학 유전학적 방법을 사용해서 원숭이의 시상하부 억제성 신경세포를 활성화시켰으며, 이를 양성자 방출 단층 촬영(PET/CT) 및 자기 공명 분광법(MRS)을 통해 검증하였다. 또한 안정 상태 기능 자기 공명 영상(Rs-fMRI)을 통해 시상하부와 전두엽 영역 간의 기능적 연결성이 증가하고, 전두엽 피질 간의 연결성이 감소하는 것을 확인하였다. 이는 해당 신경의 활성화가 목표 지향적인 행동을 조절하는 뇌 부위로 많이 알려져 있는 전두엽 피질과 관련이 있음을 보여주는 것이다. 또한, 유전자 치료(gene therapy)는 최근 바이오 업계에서 유망한 미래 신약으로 꼽히는데, 환자의 증상에 맞춰 특정 세포를 조작하고, 유전자 결함을 교정해 관련 작용을 선택적으로 억제, 또는 활성화하는 것을 의미한다. 이 연구팀은 사람과 가장 가까운 동물인 원숭이의 시상하부 외측영역에 유전자를 전달할 수 있는 바이러스를 주입해서 억제성 신경세포를 활성화시키는 것에 성공하였다. 이에 가까운 미래에 질병에 걸린 사람에게 유전자 치료를 적용해 질병들을 치료할 수 있는 가능성을 보여준 것이다.
이 논문의 제1저자인 서울대학교 의과대학 의과학과 하재선 대학원생은 “비인간 영장류 연구는 인간 적용을 위한 필요한 필수적인 연구이다. 이러한 점에서 미래 인간연구의 시작점을 대학원생 때 연구하고 또 좋은 성과를 낼 수 있었음에 기쁘다. 앞으로도 이 연구를 시초로 비만이라는 질환이 인간에게서 모두 사라지는 날이 오기를 바라본다.”라고 하였다.
특히 이 연구가 흥미로운 점은, 제1저자로 같이 논문을 작성한 서울대학교 의과대학 의학과 2학년 백인혁 학생이다. 백인혁 학생은 수리과학부를 복수전공하며 수학에 남다른 열정을 가지면서 의과대학 공부와 병행하며 본 연구에 참여하였다. 백인혁 학생은, “예과 때부터 수학과 데이터 사이언스 분야에 관심을 가졌는데 마침 직접 이런 수학과 데이터 사이언스 역량을 인공지능 코딩으로 참여할 수 있는 연구 기회를 만나 좋은 성과를 내게 되었다. 연구를 생각하고 있는 의과대학 학생이라면 수학이 아니더라도 다른 자연과학이나 공학 분야에 관심을 가지고 공부해 보는 것이 탁월한 선택이 될 수 있다.”라고 미래의 의사 과학자들에게 이야기하였다.
이번 연구는 국가과학기술연구회 선행융합연구사업, 한국생명공학연구원 주요사업, 한국기초과학지원연구원주요사업, 한국원자력의학원 기본사업, 한국연구재단의 기초 신진 연구자 지원사업/이공분야 기초연구 선도연구센터 지원사업, 한국보건산업진흥원의 보건의료인재양성사업의 지원으로 수행됐다.