[연구동향]
Physiology- or imaging-guided strategies for intermediate coronary stenosis
JAMA Network Open

(내과학교실,교신저자)

(서울대학교병원 내과,제1저자)
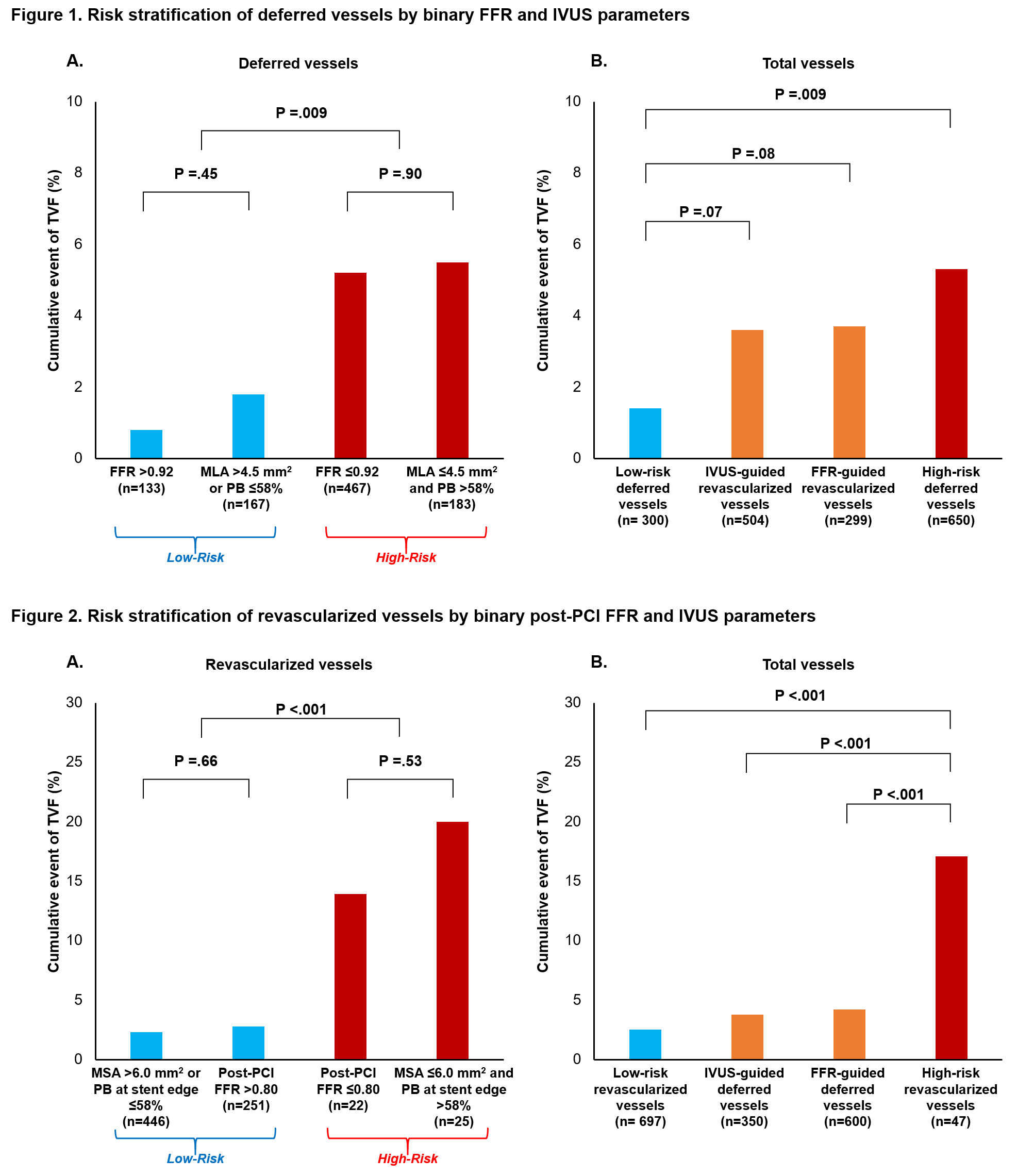
이번 연구는 다국가 다기관 무작위 배정 연구인 FLAVOUR 연구의 후속 연구로 현재 임상적으로 관상동맥 협착증을 평가하고 치료 방침을 결정하기 위해 사용되고 있는 분획혈류 예비력 (fractional flow reserve, FFR)이나 혈관 내 초음파 검사(intravascular ultrasound, IVUS)상의 지표들에 대한 검증과 예후를 더 잘 평가하고 더 적절한 치료방침을 결정하기 위한 새로운 지표들을 개발하기 위해 진행되었다. 연구에 참여한 대상자들은 연구 프로토콜에 따라 통상적으로 사용되는 기준에 따라 치료(약물치료 또는 스텐트 삽입술)가 시행되었고 대상자들의 임상적 경과를 2년간 추적 관찰하였다. FFR과 IVUS로 평가할 수 있는 지표들을 세부적으로 구분하고 이에 따라 기존에 알려진 기준 대로 치료하였음에도 불구하고 약물치료 군, 스텐트 삽입술을 받은 군 모두에서 예후를 더 잘 평가할 수 있는 새로운 FFR, IVUS 검사 기준을 제시할 수 있었다. 약물치료 군에서 FFR 0.92, IVUS상의 내강면적 4.5mm2, plaque burden 58%라는 새로운 기준을 통해 대상자의 예후를 명확하게 구분할 수 있었고 관상동맥 스텐트 시술을 받은 대상자에서는 FFR 0.8, 스텐트 내강 6.9 mm2, 스텐트 변연부 plaque burden 58%라는 기준을 통해 고위험군과 저위험군을 명확하게 구분할 수 있었다(Figure 1, Figure 2). 이런 새로운 기준들은 향후 임상에 적용되어, 기존의 치료 지침들이 가진 한계를 극복하고, 환자의 위험도를 더욱 더 잘 평가하고 이를 기반으로 더 적절한 치료 방침을 제공하는 기준으로 사용될 수 있을 것이다.
논문링크 : https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2813462
Outcomes of various classes of oral antidiabetic drugs on nonalcoholic fatty liver disease
JAMA Internal Medicine

(내과학교실,교신저자)

(보라매병원 소화기내과,제1저자)
이번 연구는 서울의대 내과학교실/서울특별시 보라매병원 연구팀과 서울대학교 보건대학원 이우주 교수 연구팀이 공동으로 수행한 연구로, 건강보험공단 빅데이터를 이용하여 2형당뇨병이 동반된 비알코올 지방간 환자에서 경구혈당강하제 중 SGLT2 억제제가 가장 유익함을 확인한 연구이다.
비알코올 지방간은 전 세계 인구의 25% 이상이 유병되어 있고 간경변증, 간세포암 등의 심각한 질병을 일으키지만 아직 치료제로 승인된 약물이 없다. 비알코올 지방간의 발생과 진행의 위험인자는 비만, 인슐린 저항성 등으로서 2형 당뇨병과 위험 인자를 공유한다. 실제로 2형 당뇨병 환자의 55.5%에서 비알코올 지방간이 동반된다. 일부 경구혈당강하제가 지방간을 개선시킬 수 있다는 산발적인 소규모 연구들에 착안하여, 본 연구팀은 지방간을 개선시킬 수 있을 것으로 알려진 경구혈당강하제 전체를 실생활 환경에서 광범위하게 비교 분석하고자 하였다.
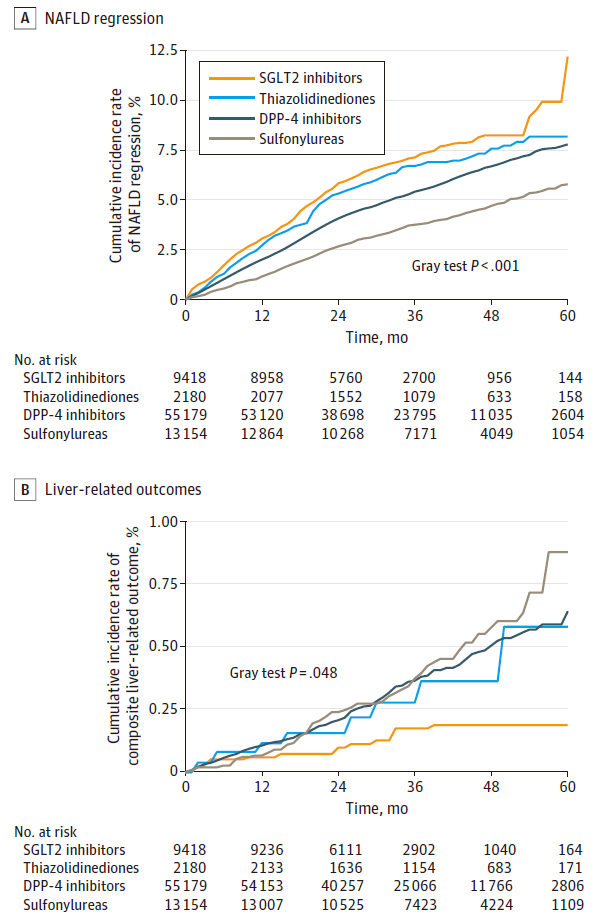
분석 대상 약제는 SGLT2 억제제, 치아졸리딘디온, DPP-4 억제제였으며 비알코올 지방간에 영향이 없다고 알려진 설포닐우레아를 대조군으로 사용하였다. 모든 약제가 대조군에 비해 지방간 호전을 잘 유도하였으나 약제간 1:1 비교에서 SGLT2 억제제가 다른 모든 약제들에 비해서 지방간 호전을 가장 잘 유도하였다. 한편, 임상적으로 중요한 지표인 간 연관 사건(간세포암, 간이식, 간 질환에 의한 입원/사망)의 위험을 낮추는 약제는 오직 SGLT2 억제제만이 유의한 연관성을 보였다.
현재 여러 가이드라인에서 2형 당뇨병 환자에 경구혈당강하제는 메트포르민을 일차 약제로 사용하고 있으며 심혈관 질환이 있을 경우 SGLT2 억제제가 우선 권고되고 있다. 비알코올 지방간 환자에게는 아직까지 우선 권고되는 약제가 없는데 지방간의 개선과 간 연관 사건의 발생을 낮추기 위해 향후 SGLT2 억제제를 우선 권고할 수 있을 것이다.
본 연구는 국립보건연구원의 지원을 받아 수행하였으며, 유병률이 높으나 아직 치료제가 없어 의학적으로 중요한 미충족 수요인 비알코올 지방간의 치료제에 대해 빅데이터 분석으로 현재 가용한 약물인 SGLT2 억제제의 유용성을 밝힌 연구이다. 후향적인 데이터가 필연적으로 가지는 여러 가지 비뚤림의 문제가 있었지만 서울대학교 보건대학원과의 협업으로 하나씩 해결하며 기존 연구들에 비해 임상 현실을 충실히 반영한 우수한 연구 성과를 얻을 수 있었다.
논문링크 : https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2814646
Safety and efficacy of a novel anti-CD19 chimeric antigen receptor T cell product targeting a membrane-proximal domain of CD19 with fast on- and off-rates against non-Hodgkin lymphoma: a first-in-human study
Molecular Cancer

치유 불가능한 질병으로 고통받고 있는 환자들은 기존에 존재하지 않았던 새로운 치료법의 등장을 절실히 희망하고 있다. 과학에 대한 꾸준한 투자와 수많은 연구자의 노력의 결과로 지금까지 활용되어 온 화학적으로 합성한 약품이나 세포에서 생산한 바이오 의약품과는 다른 “살아 있는 약품(living drug)”이 등장하여, 많은 환자들에게 희망을 주고 있다. Living drug은 살아있는 바이러스, 세포, 유전적으로 변형된 세포이거나, 우리 체내의 세포를 약품으로 변화시킬 수 있는 약품을 의미한다. 이러한 living drug은 기존 약품과는 매우 다른 특성을 보인다. 한편으로는 기존 약품에 비하여 매우 강력한 치료 효능을 보이기도 하지만, 인체에 광범위하면서 지속적인 변화를 유도하여 심각한 합병증을 유발시키기도 한다.
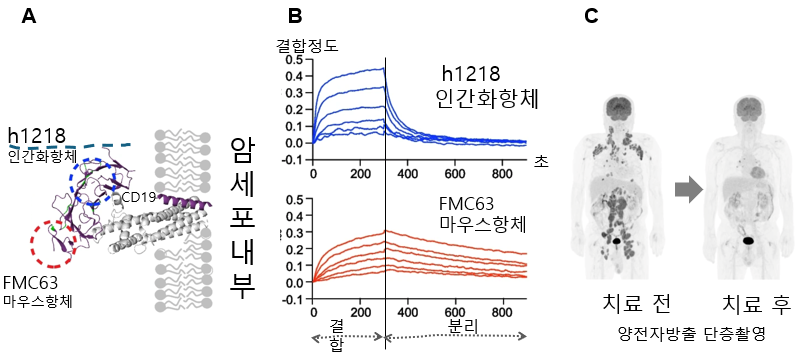
이러한 living drug에는 세포치료제, 유전자 치료제, 유전자 삽입 세포 치료제 등이 있으며, chimeric antigen receptor (CAR) T 세포 치료제가 가장 광범위하게 이용되고 있다. 현재 4종의 CD19 대상 CAR T 세포치료제가 B 세포 백혈병 및 림프종 약품으로, 2종의 BCMA 대상 치료제가 다발성 골수종 약품으로 허가 받아 이용되고 있다. CD19 대상 CAR T 세포 치료제는 백혈병에서 매우 우수한 치료 효과를 보이지만, 림프종에서는 제한적인 효과를 보인다. 기존의 CD19 대상 CAR T 세포 치료제는 모두 동일한 FMC63 마우스 항체 유래의 single chain variable fragment(scFv)를 CAR에 이용하고 있다. 본 연구진은 새로운 CD19 인간화 항체(h1218)를 제조하고, 이를 이용한 CAR T 세포 치료제(AT101)를 개발하고 있다. 이 h1218 항체는 FMC63 대비 세포막에 좀 더 가까운 부위(epitope)에 결합하고(그림 A), CD19에 좀 더 빨리 결합하고 빨리 해리되는 특성을 보여(그림 B), CAR T 세포가 지속적인 자극에 의해 불활성화(anergy)에 빠지는 확률이 낮을 것으로 예상되고 있다. AT101 CAR T 세포 치료제는 임상 1상 시험에서 높은 객관적 반응률(overall response rate, ORR)과 안전성을 보였으며(그림 C), 대부분의 환자에서 오랜 기간 치료효과가 지속되고 있다. 이러한 우수한 임상 1상 결과를 바탕으로, 현재는 AT101 CAR T 세포 치료제의 임상 2상 시험이 진행되고 있다. 이 연구는 생화학교실의 정준호 교수, 앱클론, 펜실바니아 의과대학 Marco Ruella 교수, 서울아산병원 윤덕현 교수 연구진이 공동으로 진행하였다.
논문링크 : https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01886-9
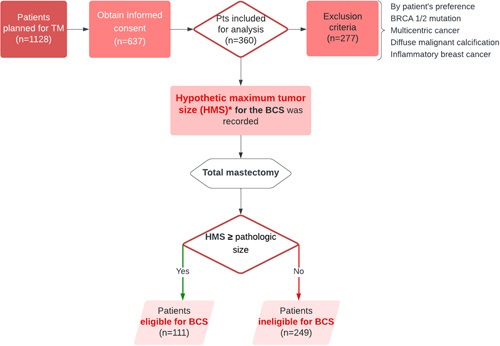
The percentage of unnecessary mastectomy due to false size prediction using preoperative ultrasonography and MRI in breast cancer patients who underwent neoadjuvant chemotherapy: a prospective cohort study
International Journal of Surgery

(외과학교실,교신저자)

(원자력병원 외과,제1저자)
외과에서는 수술 전 영상검사에 의해서 유방암 환자에서 유방전절제술 또는 유방보존수술을 할 것인지를 결정한다. 그러나 이런 결정이 얼마나 옳았는지에 대한 연구가 없었다. 특히 수술 전 선행항암치료(neoadjuvant chemotherapy)를 받은 환자에서는 영상검사에서의 종양크기가 실제 병리학적 크기와 차이가 크다는 연구들이 많다. 본 연구에서는 2018-2021년 서울대병원에서 유방암으로 전절제술을 받는 360명의 환자들을 전향적으로 연구하였다. 외과의사들은 수술 전에, 이 환자의 유방크기와 종양의 위치를 고려할 때 실제 암크기가 몇 cm 이하였다면 유방보존수술을 할 수 있었을 것이라는 가상의 크기를 기록하였다(hypothetical maximum tumor size, HMS). 이것을 수술 후 최종병리 결과상의 암크기와 비교하였다.
그 결과 선행항암치료를 받은 환자에서는 47.7%, 수술 먼저 하는 환자에서는 21.3%에서 실제 병리학적 암크기가 HMS보다 작았다. 선행항암치료를 하는 환자에서 유의하게 더 이 비율이 높았다(p<0.001). 이후 선행항암치료를 한 환자들에 국한한 분석에서, HER2양성(63.3%)이거나 삼중음성암 환자(57.6%)에서 호르몬양성/HER2음성 환자(25.0%)들보다 더 유의하게 종양크기 추정 오류로 전절제를 받는 비율이 높았다(p<0.001). 여기에 기여하는 요인으로는 선행항암치료 환자에서 MRI 검사가 가장 크게 기여했고, MRI를 하지 않았다면 이러한 오류를 21.5% 감소시킬 수 있었다.
이러한 결과는 선행항암치료를 받은 HER2 양성 혹은 삼중음성 유방암환자가 유방보존수술을 원할 때, 영상에서 보이는 암 크기, 특히 MRI 검사만에 근거해 유방전절제술을 결정하는 것은 좀 더 신중해야 함을 시사한다.
Associations of cholecystectomy with metabolic health changes and incident cardiovascular disease: a retrospective cohort study
Scientific Reports

(가정의학교실,교신저자)

(의과학과 석박통합과정,제1저자)
담낭절제술은 가장 흔한 장기 제거 수술 중 하나이며, 유증상 담석, 급성 및 만성 담낭염, 담낭용종을 포함한 다양한 적응증에 대해 수행된다. 담낭절제술은 전형적으로 환자의 건강에 장기적으로 큰 영향을 미치지 않는 단순하고 양성인 수술로 간주되지만, 사실 소화 대사에 있어 중요한 생리학적 변화와 관련이 있다. 담낭은 식이 지방의 유화 및 흡수를 위한 담즙의 저장 및 방출에 중요한 역할을 한다. 장간 순환의 무결성은 소화관의 항상성 및 장내 미생물 무리의 균형을 유지하는 데 중요하다. 외과적으로 담낭을 제거하는 것은 장간 순환 및 장내 미생물 무리의 종류 및 수를 크게 변화시키는 것으로 나타났다. 따라서 이러한 체내 변화는 지질 대사에 영향을 미칠 수 있다
2020년, 담낭절제술은 전년보다 증가한 84,000건 이상으로 국내에서 다섯 번째로 흔한 수술이었다. 증가하는 추세에도 불구하고, 담낭절제술이 전신 질환의 위험에 미치는 단기 또는 장기적인 영향의 기전에 대해서는 아직까지 이해가 부족하다. 이전 논문들은 담낭절제술 후 대장암의 위험이 증가하였고, 특히 여성에서 위험이 증가하였음을 보여주었다. 또한, 비알콜성 지방간을 동반한 대사증후군에 대한 연구에서는 담낭절제술을 받은 환자들이 대사증후군의 위험이 증가하였고, 비알콜성 지방간 질환의 위험도가 더 높았다. 그러나 이러한 연구들은 담낭절제술 후 질환과 연관된 중간 기전을 설명하지 못하였다.
심혈관질환은 전 세계적으로 사망의 주요 원인 중 하나이다. 예방적 노력은 심혈관질환의 가장 큰 위험 인자인 대사증후군을 해결하고 수정하는 데 초점을 맞추고 있다. 수술 후 대사의 변화가 환자의 심혈관질환 위험에 영향을 미칠 가능성이 있다. 담낭절제술 후 일어나는 생리학적 변화가 대사증후군 지표와 결과적으로 심혈관질환 위험에 영향을 미칠 수 있다고 가설을 세웠다. 본 연구의 목적은 담낭절제술에 따른 대사증후군 지표의 단기적 변화와 심혈관질환의 장단기 위험을 분석하는 것이었다.
담낭절제술은 관상동맥 심장질환(CHD)의 위험을 증가시켰다(조정된 위험비 [aHR]: 1.22, 95% CI: [1.07-1.40]). 담낭절제술 후 2년 이내에 담낭절제술은 심혈관질환 [CVD] (aHR 1.35, 95% CI 1.15-1.58) 및 CHD (aHR 1.77, 95% CI 1.44-2.16). 담낭절제술은 같은 기간 동안 수축기 혈압 (조정된 평균 [aMean]: 1.51, 95% CI: [-1.50 ~ -4.51]), 총콜레스테롤 (aMean -14.14, [-20.33 ~ 7.95]) 및 체질량지수 (aMean -0.13, [-0.37 ~ 0.11])의 변화와 관련이 있었다. 그러나 담낭절제술을 받은 환자의 경우 2년 후 연관성이 감소했다.
담낭절제술 환자는 단기적으로 심혈관질환 위험이 상승했는데, 이는 수술 전 환자의 특성 때문일 것이다. 담낭절제술을 받은 환자에서 2년 후 담낭절제술과 심혈관질환의 연관성이 감소하여 대사건강의 개선으로 담낭절제술 후 2년 후에는 담낭절제술 관련 심혈관질환 위험 상승이 개선될 수 있음을 시사한다.

Rise in broadly cross-reactive adaptive immunity against human β-coronaviruses in MERS-recovered patients during the COVID-19 pandemic
Science Advances

(미생물학교실,교신저자)

(미생물학교실,제1저자)

(의학연구원,제1저자)
코로나19 팬데믹은 종료되었고 백신과 치료제들이 사용되고 있지만, 지속적인 변이 바이러스들의 출현으로 인해 코로나19 감염의 피해는 계속되고 있다. 따라서 보다 효과적인 백신과 치료제를 개발할 필요성이 있다. 또한 반복되는 신종 코로나바이러스 출현과 확산(2002년 사스, 2012년 메르스, 2019년 코로나19)에 대비하기 위해서도 다양한 코로나바이러스 감염을 통제할 수 있는 광범위 코로나바이러스 백신과 치료제가 필요하다.
본 연구는 코로나바이러스에 대한 광범위 교차 면역에 대한 중요한 특성들을 밝혀냄으로써 광범위 코로나바이러스 백신과 항체 치료제 개발을 위한 기초의학적 토대 마련에 기여하였다.
조남혁 교수(미생물학교실) 연구팀은 충남대학교병원 김연숙 교수, 국립중앙의료원 임동균 박사, 한국파스퇴르연구소 김승택 박사 연구팀 및 국내 여러 병원과 대학의 연구팀들과 협력하여 2015년 발생한 국내 메르스 사태 후 회복된 환자들을 대상으로 코로나바이러스들에 대한 면역반응의 변화양상을 추적 검사하였다. 이러한 환자들을 대상으로 연구팀은 코로나19 팬데믹 동안 또다른 신종 코로나바이러스(SARS-CoV-2) 감염이나 백신 접종이 시행되었을 때 나타나는 코로나바이러스 특이적 항체반응과 T 세포 반응의 특성을 분석하였다.
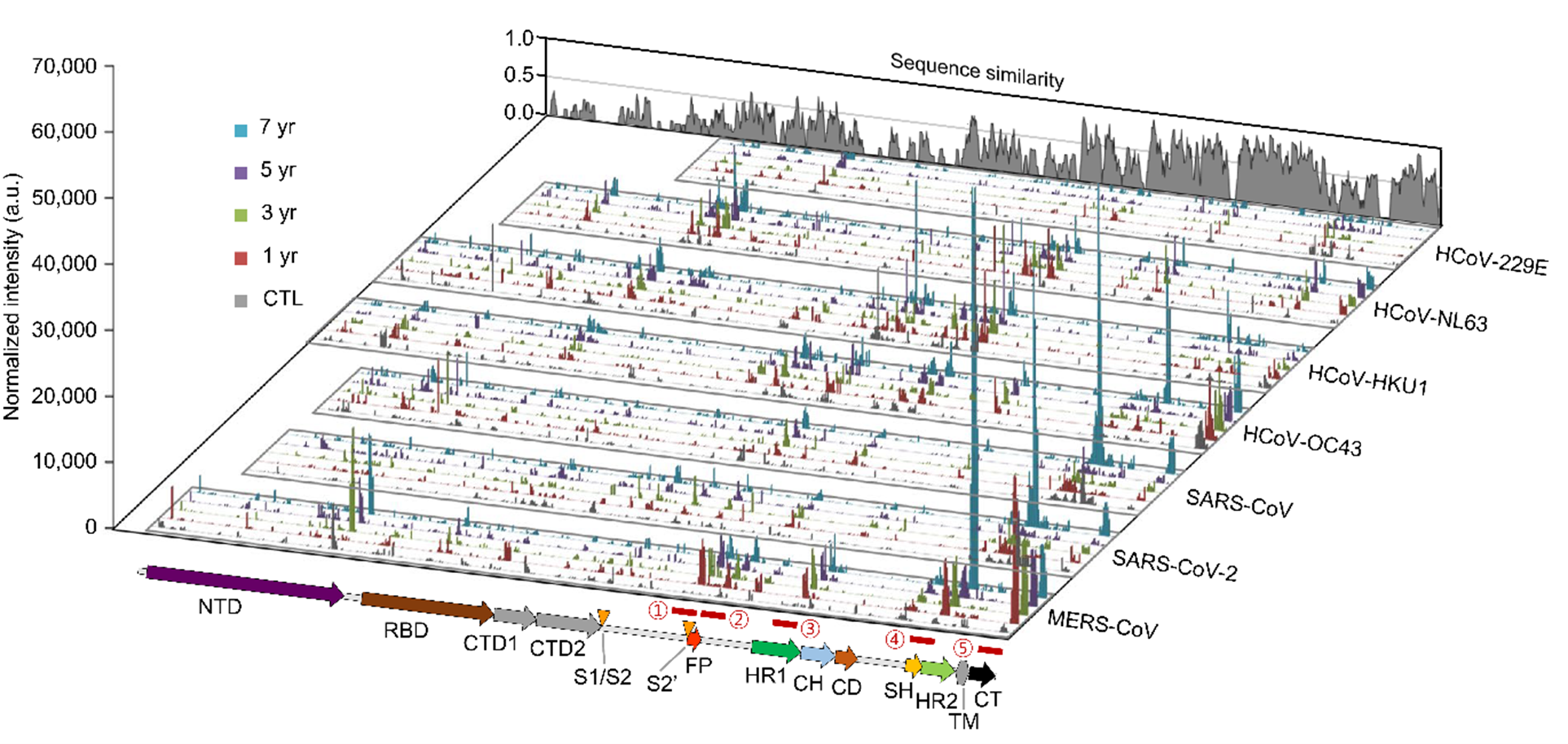
2016년부터 진행된 7년간의 장기 추적 연구를 통해 서로 다른 신종 코로나바이러스들에 순차적으로 노출되면 여러 가지 코로나바이러스들에 대한 광범위 항체반응과 T 세포 반응이 증가하는 것을 확인하였다. 특히 바이러스 감염을 억제할 수 있는 중화항체 반응이 메르스를 앓았던 사람에서 그렇지 않았던 사람들보다 더 많이 증가하는 것을 확인하였으며, 중화항체의 표적이 되고 면역원성이 높은 코로나바이러스들의 보편적 항원 부위들을 밝혀냈다. 또한 다기능성 면역기억 T 세포들의 활성이 코로나19 팬데믹 동안 증가하여 코로나바이러스 특이적 교차 적응면역반응이 증가하는 현상을 관찰하였다. 이러한 연구 결과들은 다양한 코로나바이러스 감염에 대해 보편적으로 작용하여 감염을 억제하거나 질병 중증화를 예방할 수 있는 광범위 코로나바이러스 백신이나 중화항체 치료제 개발에 필요한 중요한 과학적 정보를 제공할 수 있으며, 반복되는 코로나바이러스 감염병을 통제하기 위한 의생명기술개발의 근거를 마련할 수 있을 것으로 기대된다.