[연구동향]
Versatile roles of innate lymphoid cells at the mucosal barrier: from homeostasis to pathological inflammation
Experimental & Molecular Medicine

(의과학과,교신저자)

(가천대학교 의생명과학과,
공동제1저자)

(의과학과,공동 제1저자)
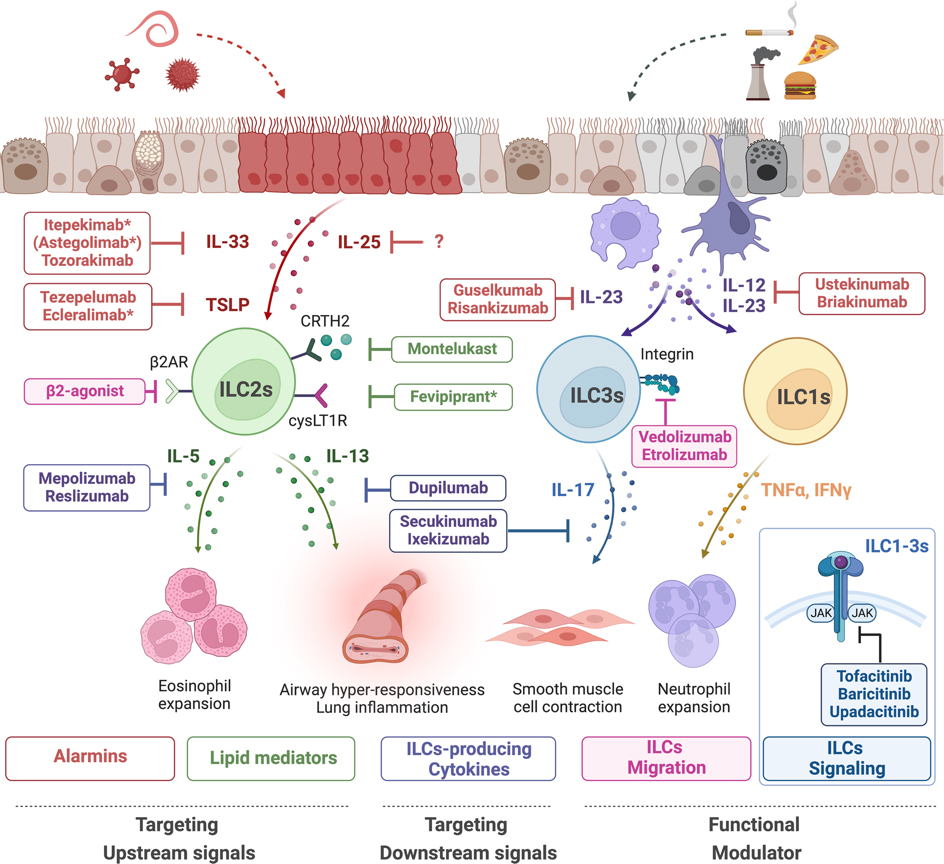
인체는 지속적으로 병원체와 외부 유해자극에 노출되며, 이러한 상황에서 점막조직은 중요한 방어기전을 제공한다. 즉, 점막 면역 시스템은 단순히 조직의 항상성을 유지하는 것뿐만 아니라, 개체 전체의 면역 반응을 조절하는 역할을 담당한다. 특히 최근에는 주로 점막 조직에 상주하는 선천성림프구세포가 점막 면역의 중요한 조절자로 주목받고 있다. 선천성림프구세포는 항원 특이적인 수용체를 발현하지는 않지만, 주변 환경을 감지하고 빠르게 활성화되는 능력을 가지고 있다. 이러한 선천성림프구세포는 빠르게 다량의 사이토카인을 분비하여 조직의 항상성을 유지하고 염증 반응을 조절할 수 있다. 따라서 선천성림프구세포의 기능을 효과적으로 조절한다면 다양한 질환의 치료 목적을 달성할 수 있다.
이에 본 연구진은 점막 조직의 항상성 유지와 다양한 질환의 효과적인 치료를 위해 선천성 림프구세포의 기능을 검토하였으며, 면역 관문 억제제를 비롯한 다양한 생물학적 약물을 활용한 선천성림프구세포의 효과적인 조절 전략을 제안하였다.
Multiparity increases the risk of diabetes by impairing the proliferative capacity of pancreatic β cells
Experimental & Molecular Medicine

(내과학교실,교신저자)

(내과학교실,제1저자)
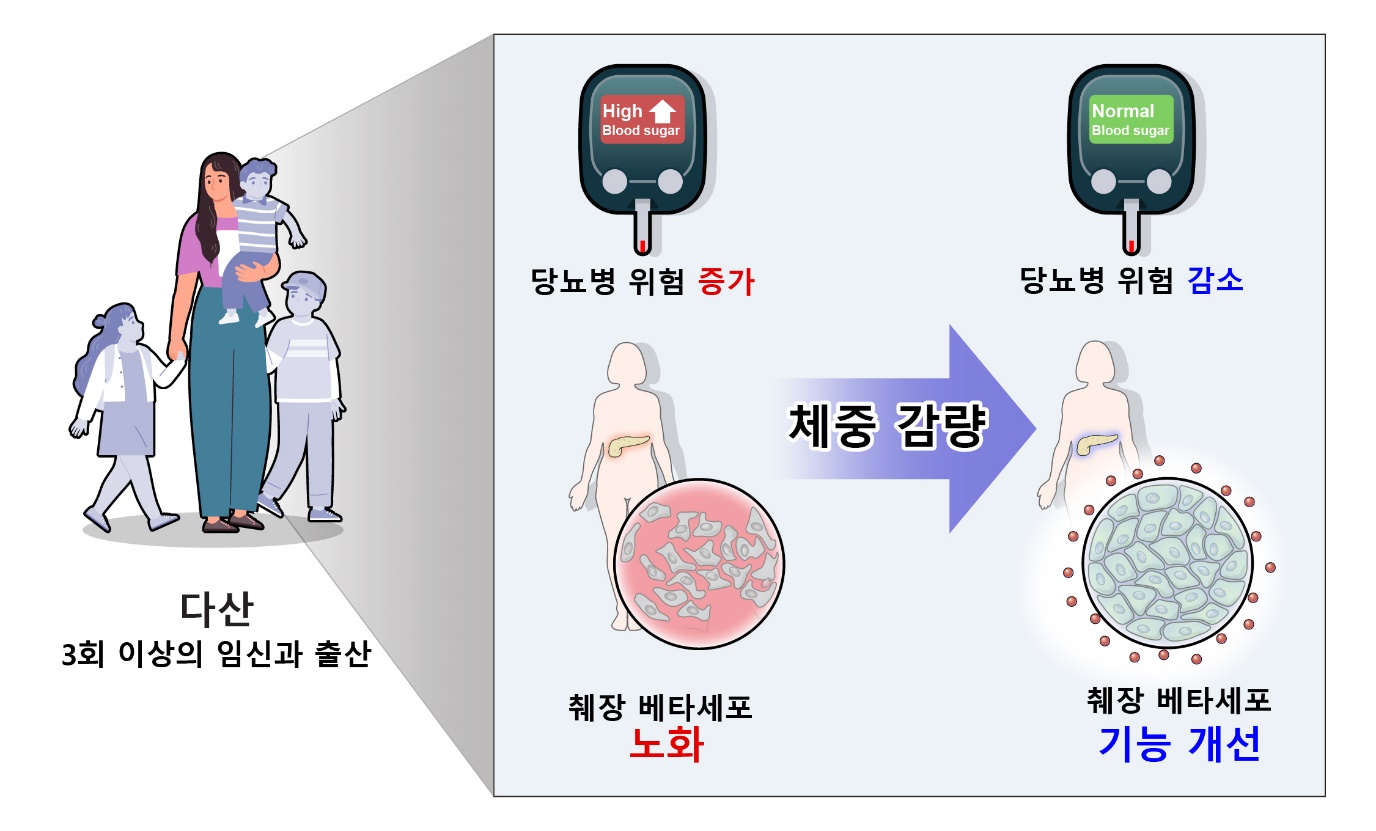
임신 중 산모는 10kg 이상의 체중 증가 및 호르몬 변화로 심한 인슐린 저항성 상태에 노출되고 이는 출산 후 대사질환 위험을 높일 수 있다. 여러 번의 임신과 출산, 즉 다산은, 산모에게 대사적으로 부담이 될 것으로 예상되지만 그 기전에 대해 그간 연구된 바가 없다.
본 연구에서는 사람과 마우스 모델 모두에서 다산이 당뇨병 위험 및 췌장베타세포에 미치는 영향을 분석하였다. 3회 이상 출산 경험이 있는 다산 산모의 경우 상대적으로 비만하고 출산 후 혈당이 높았다. 다산 경험이 있더라도, 출산 후 체중을 감량한 산모는 (분배지수로 계산된) 췌장베타세포 기능의 개선이 10% 있었고, 반면 출산 후 체중이 증가한 산모는 췌장베타세포 기능이 30% 감소되었다. 다산 마우스의 췌장 베타세포를 단일세포RNA시퀀싱 분석을 하였고, 다산 췌장베타세포의 노화와 세포스트레스가 증가되고, 인슐린 분비능과 세포 호흡기능이 저하되었다.
이를 통해 여러 번의 임신과 출산이 산모에게 대사적으로 당뇨병 위험의 증가와 췌장베타세포노화 및 기능 저하를 동반할 수 있음을 규명하였다. 따라서 출산 후 당뇨병에 대한 철저한 관리가 필요하고, 특히 체중감량을 통해 췌장베타세포기능과 인슐린감수성의 개선 및 당뇨병 위험을 감경시킬 수 있음을 밝혔다.
이러한 내용은 2023년 대한당뇨병학회 진료지침에도 반영된 내용으로, ‘체중감소와 수유를 통해 산후 당뇨병의 위험을 줄일 수 있다’라고 지침에서 권고되고 있다.
Co-delivery of metabolic modulators leads to simultaneous lactate metabolism inhibition and intracellular acidification for synergistic cancer therapy
Advanced Materials

(영상의학교실,교신저자)

(서울대학교 화학생물공학부,
교신저자)

(영상의학교실,제1저자)

(서울대학교 화학생물공학부,
제1저자)
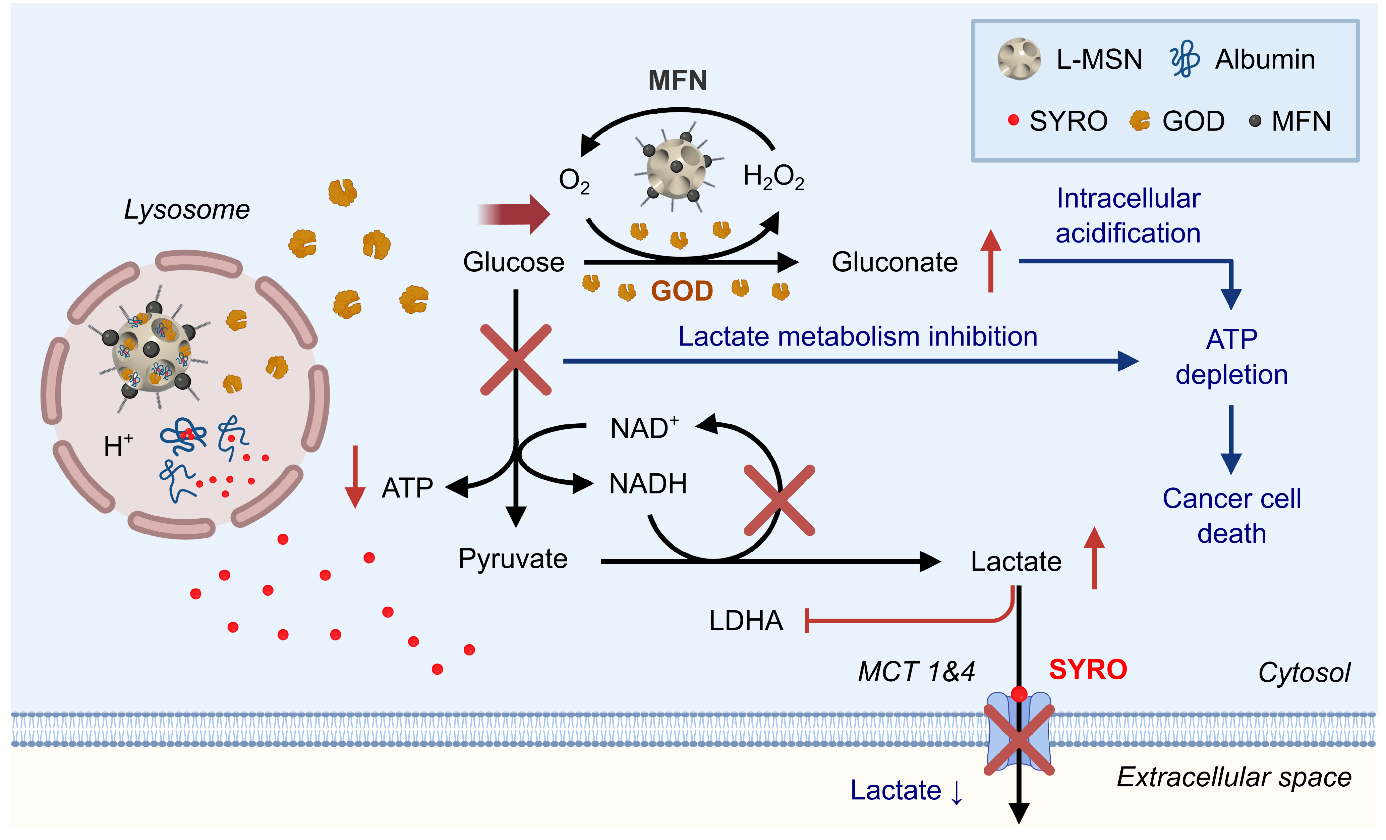
본 연구는 서울대학교 의과대학 영상의학교실 연구팀과 서울대학교 화학생물공학부 현택환 교수 연구팀이 공동으로 수행하였다. 암세포에서 lactate metabolism을 억제하고 내부를 산성화하면 adenosine triphosphate(ATP)가 고갈되어 암세포가 죽을 수 있는데, 다음 기작과 관련하여 시너지를 보이는 약물 조합을 동시에 전달함으로써 더욱 효과적으로 암을 치료하였다.
암세포의 가장 대표적인 metabolism은 바로 lactate metabolism인데, 높은 비율로 glycolysis에 의존하여 ATP를 합성하고 과량의 lactate를 생산한다. ATP 합성을 위해서 세포 내부는 알칼리성이어야 하므로 생산된 lactate는 monocarboxylate transporter 1&4(MCT1&4)를 통해 밖으로 방출된다. 따라서 lactate metabolism을 억제하고 암세포 내부를 산성화시키는 전략은 암세포의 ATP를 고갈시켜 죽이는 데 효과적일 것으로 기대된다. 현재까지 해당 기작을 위해 보고된 약물은 대표적으로 MCT1&4 저해제가 있는데, 이는 아직 효과가 미미하기 때문에 단독으로 치료에 쓰이기에 어려움이 많다. 이에 더욱 효과적인 암치료를 위해 다른 대사 조절제와의 조합이 중요한 상황이다.
본 연구에서는 MCT1&4 저해제와 glucose oxidase(GOD)라는 효소와의 조합으로 시너지 있게 암 사멸을 유도했다. GOD는 glucose와 산소를 이용하여 gluconate와 과산화수소를 발생시키는 효소이다. MCT1&4 저해제가 MCT1&4를 막으면 lactate 방출이 감소하면서 세포 내부의 lactate 양이 증가하게 된다. 그러면 lactate dehydrogenase A(LDHA) 액티비티가 감소하고 nicotinamide adenine dinucleotide(NAD+)가 결핍되면서 glycolysis가 억제된다. 이로 인해 glucose가 lactate metabolism 방향으로 덜 사용되고 결국 GOD 반응 쪽으로 더 많이 사용된다. 증가한 GOD 반응은 더 많은 glucose 감소와 gluconate 생성을 유도하여 lactate metabolism 억제와 세포 내부 산성화를 강화시킨다. 이 시너지는 ATP 감소에서도 나타나 더욱 효과적인 암사멸을 유도할 수 있었다. Lactate metabolism은 암세포에서 특이적이기 때문에 해당 시너지는 암세포에서만 발견되었고, 정상세포에서는 약물 처리에도 높은 viability를 유지하였다. 이 결과는 동물실험에서도 동일하게 확인되었는데, 동물실험에서는 추가로 과산화수소로부터 산소를 생산하는 manganese ferrite nanoparticle(MFN)을 이용하여 산소가 부족한 암 환경에서도 GOD가 액티비티를 유지할 수 있도록 하였다. 또한, 해당 약물들은 lactate 양을 효과적으로 줄여줄 수 있는데, extracellular lactate가 암 전이에 큰 영향을 주기 때문에 전이된 암에도 적용시켜 보았고, 우수한 치료 효과를 확인했다.
Combination therapy에서는 효과적인 치료를 위해 pharmacokinetic behavior가 다른 여러 약물들을 동시에 전달하여 in vivo biodistribution을 통일시키는 것이 매우 중요하다. 본 연구에서는 약물들을 동시에 전달하기 위해서 large-pore mesoporous silica nanoparticle을 사용하였다. 나노입자인 MFN은 silica nanoparticle 표면에 결합시켰고, 단백질인 GOD는 large pore 안에 담지하였으며, 작은 분자인 MCT1&4 저해제는 large pore에 바로 담지할 수 없기 때문에 biocompatible albumin을 carrier로 활용하여 large pore 안에 담지하였다. 본 연구는 작은 분자, 단백질, 나노입자 등 다양한 형태의 대사 조절제를 동시에 전달하여 시너지한 암치료 방법을 개발했다는 점에 큰 의의가 있다. 이는 최근 많은 관심을 받고 있는 drug delivery system(DDS) 분야에서의 획기적인 발전과 4세대 항암제로 각광받고 있는 대사 항암제의 개발에 큰 기여를 할 것으로 기대된다.
논문링크 : https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202305512

