[연구동향]
Reverse Remodeling Assessed by Left Atrial and Ventricular Strain Reflects Treatment Response to Sacubitril/Valsartan

황인창 교수
(내과학교실/분당서울대학교병원 순환기내과)
박출률 감소 심부전 (HFrEF) 환자에서 적절한 약물치료를 통해 심기능이 호전될 수 있다는 점은 잘 알려져 있으며, 심기능의 호전 여부를 의미하는 ‘역 재형성 (reverse remodeling)’은 일반적으로 좌심실과 좌심방의 크기 변화 및 좌심실 박출률(LV ejection fraction)의 변화로 평가하고 있다. 하지만 기존 방식으로는 심기능의 호전 정도를 판단하는데 한계가 있으며, 심장의 ‘역 재형성’을 정확히 평가할 수 있는 지표에 대한 임상적 필요성이 제기되어 왔다. 한편, speckle-tracking echocardiography 로 평가한 좌심실의 global longitudinal strain (LVGLS) 및 좌심방의 reservoir strain (LARS)은 기존 지표들에 비해 심기능을 민감하게 반영할 수 있다고 알려져 있다.
본 연구에서는 sacubitril/valsartan을 투여받고 있는 HFrEF 환자에서 LVGLS와 LARS의 시간에 따른 변화 양상을 최초로 분석하였으며, 이를 통해 심부전의 ‘역 재형성’을 새롭게 정의하였다. 본 연구에서 정의한 ‘LVGLS 및 LARS 변화 양상에 따른 역 재형성 지표’는 기존 방식에 비해 심부전 환자의 치료 반응을 더욱 정확하게 반영할 수 있으며, 예후 예측력도 더 우수한 것으로 확인되어, 심부전의 효과적인 치료에 기여할 것으로 기대된다.
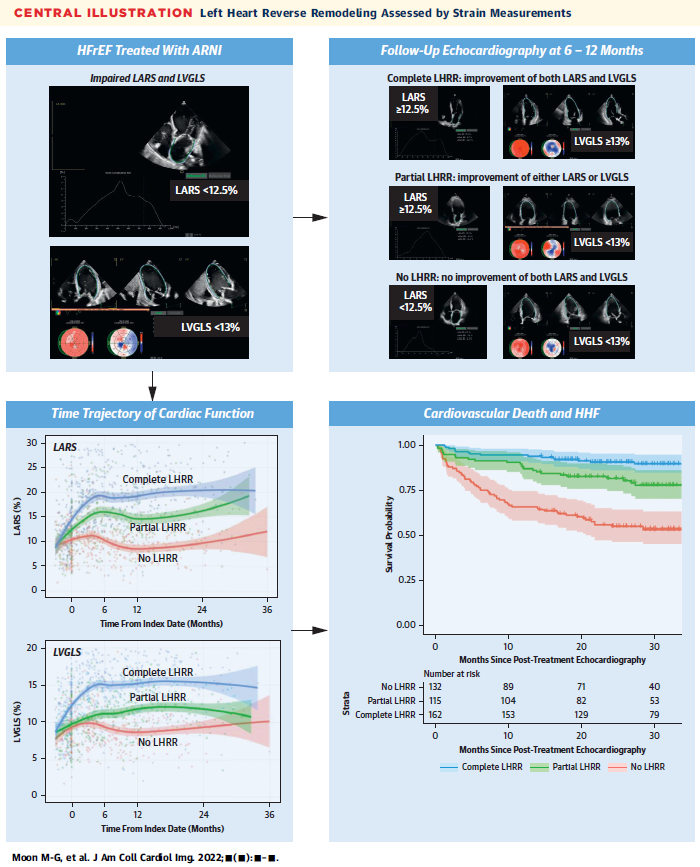
<LV global longitudinal strain 및 LA reservoir strain으로 평가한 심기능 변화 양상 및 예후>
논문링크 : https://www.jacc.org/doi/abs/10.1016/j.jcmg.2022.03.019
Multifocal Organoids Reveal Clonal Associations between Synchronous Intestinal Tumors with Pervasive Heterogeneous Drug Responses

구자록 교수
(의과학과)

김민정 교수
(외과학교실)

정나현 연구원
(암연구소, 제1저자)
동시성 암(synchronous tumor)은 초기 진단 시 환자의 동일하거나 다른 장기에서 발견된 2개 이상의 원발성 종양으로 정의된다. 장관에서 확인된 다발성 원발성 암의 발병률은 드물며, 특히 이러한 환자들 유래 오가노이드 및 세포주 개발과 이를 활용한 멀티오믹 데이터 연구는 문헌상으로는 거의 없는 것으로 확인하였다.
본 연구에서는 단일 환자에서 소장-대장의 장관 전체에 걸쳐 발생한 동시성 대장암에서 환자유래 오가노이드(PDO), PDO 유래 세포주 (PDOC) 및 환자유래 세포주(PDC)를 각각 6종씩 수립하였으며, 이를 활용하여 동시성 대장암의 종양간 이질적인 유전적인 특성을 확인하였다. 전사체 및 후성 유전적 변화를 소장과 대장에 이르는 각각 6개의 종양 조직, 종양 오가노이드, 종양 세포주, 종양 오가노이드 유래 세포주에서 관찰하였다. 한 환자에서 수립된 종양오가노이드와 종양세포주 18종에서 약물 반응성을 확인함으로써 종양 간의 분자적인 이질성과 종양 간의 독립적인 클론의 특성과 각 서브 클론 간의 연관성을 확인하였다. 이러한 유전체, 후성 유전체와 약물 반응성을 통합하는 멀티 오믹스 데이터로 동시성 대장암 모델의 분자적 특성과 약물 반응 간의 상관 관계를 확인함으로써, 미래에는 동시성 암환자에게 적절한 환자 맞춤형 치료 표적을 제시할 수 있을 것으로 판단된다. 본 연구는 한국연구재단(다부처 생명연구자원 선진화사업, 배양세포 클러스터 육성), 한국세포주연구재단, 서울대학교병원의 지원으로 수행되었다.
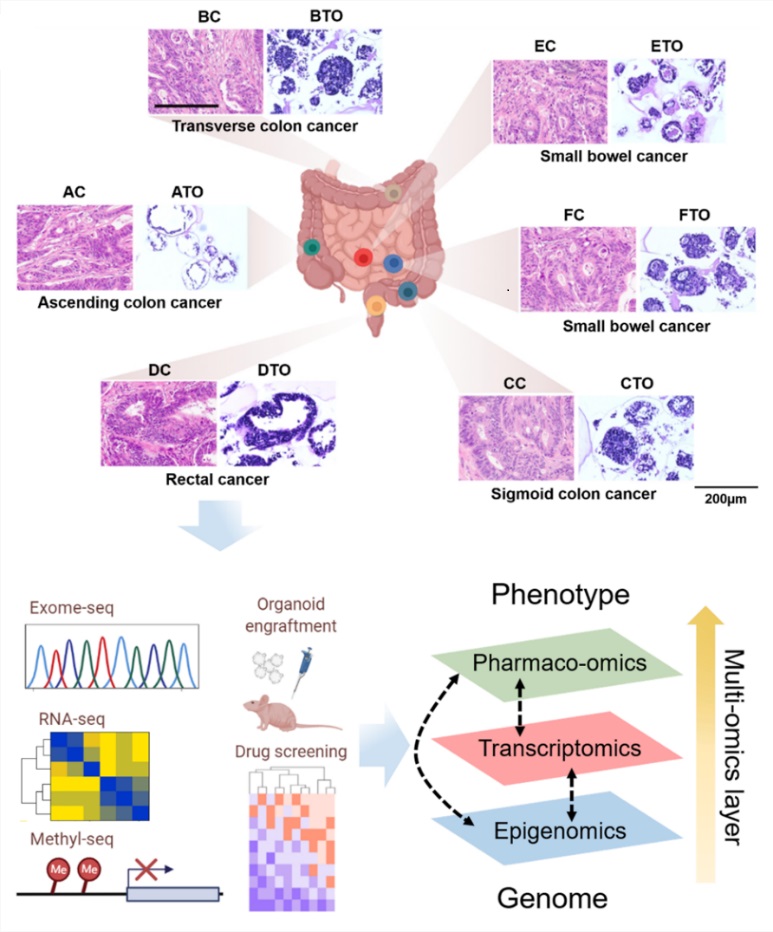
<단일 동시성 대장암(SIC) 환자로부터 유래한 6개의 오가노이드 및 12개의 세포주(6개의 환자 유래 세포주와 6개의 오가노이드 유래 세포주)를 성공적으로 수립. 수립된 모델을 통해 멀티 오믹스 데이터를 비교하고 약물 반응에 영향을 줄 수 있는 이질적 요인을 확인함. >
Alterations in blood proteins in the prodromal stage of bipolar II disorders

안용민 교수
(정신과학교실)
양극성 장애의 조기발견과 조기개입은 양극성 장애의 진행을 예방하는 데에 중요하다. 그러나 증상이 불분명하고 비교적 진행 초기 단계의 환자에게, 조기 약물치료를 시작하는 부분에 대해서는 임상의 마다 견해가 다를 수 있다. 따라서 본 연구에서는 양극성 장애의 진단기준을 충족하지 못하는 고위험 상태의 환자에게서도 혈액 단백질 마커의 변화가 발견되는지를 확인하고자 하였다. 이를 위해 양극성 장애 고위험군 40명의 피험자, 48명의 양극성 장애 환자군, 75명의 정상대조군의 혈액 단백체 발현량을 비교하였다. 다중 검지법 (Multiple Reaction Monitoring-Mass spectrometry, MRM-MS) 방법을 사용하여 158개의 목표 펩타이드를 높은 정확도로 측정하였다. 측정된 총 158개의 Peptide 중 26개의 유의한 펩타이드가 세 군간 유의한 차이를 보였다. 이 중 19개의 peptide는 고위험군에서 다른 두 군과 유의한 발현량의 차이를 보였다. 두 개의 단백질은 (CHGA, QSOX1) 양극성 장애 고위험 상태에서 나머지 두 군과 비교하여 발현량이 증가되었으며, 이 두 단백질은 염증을 촉진하고 신경 전달 장애를 일으키는 것과 관련이 있었다. 양극성장애 고위험 상태에서 발현량이 감소한 나머지 펩타이드들은 혈액 응고, 면역 반응, 지질 대사, 시냅스 가소성과 관련된 단백질들이었다. 이 연구에서 양극성 장애 고위험 상태에서 발견된 유의미한 단백질 발현량의 변이들은, 선행 연구에서 주요 정신 질환 환자들에게서 보고된 단백질들이었다. 이러한 결과는, 양극성 장애 환자군과 관련된 병태 생리학적 변화가 이미 고위험 상태에서부터 발생하였음을 시사하며, 따라서 질병의 진행을 막기 위한 초기 약물 치료가 필요할 수 있음을 시사하는 바이다.
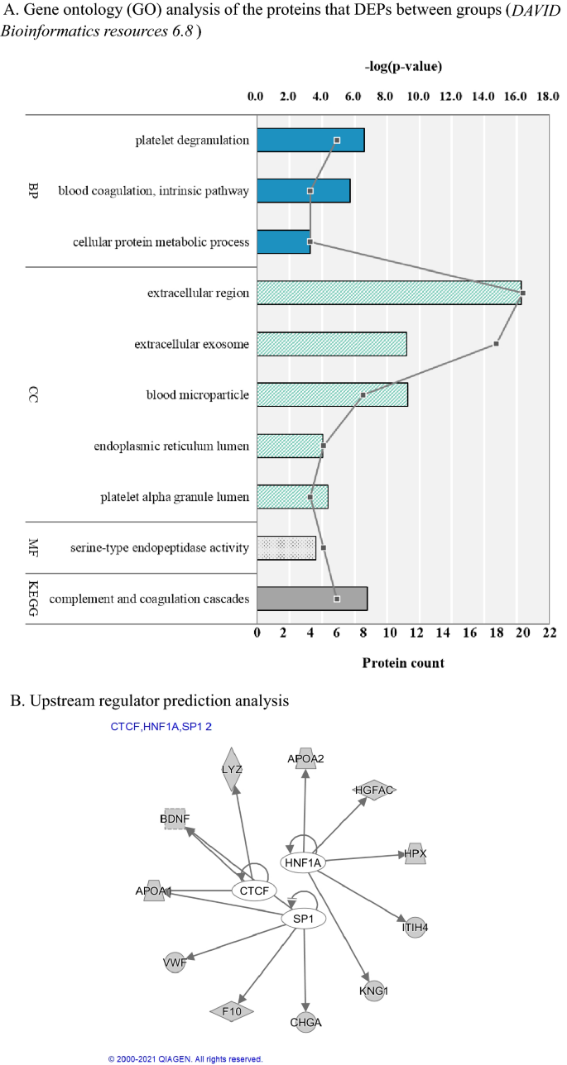
< 고위험 상태를 반영하는 단백질들의 Bioinformatics 분석 결과 >

