[연구동향]
Low-dose chest computed tomographic screening and invasive diagnosis of pulmonary nodules for lung cancer in never-smokers
Eur Resp J, 2020

김연욱 교수(내과학교실) 이춘택 교수(내과학교실)
폐암은 병기에 따른 생존율의 차이가 큰 병으로, 조기에 발견하여 치료하는 것이 중요하다. 따라서 최근 폐암 검진 목적으로 저선량 흉부 단층촬영(LDCT)을 촬영하는 사람이 꾸준히 증가하고 있고, 이에 따라 발견되는 폐결절의 유병률도 지속적으로 증가하고 있다. 그러나 기존에 LDCT를 이용한 폐암 검진의 성과를 분석한 대규모 연구들은 대부분 평생 다량의 담배를 흡연한 사람들을 대상으로 하여, 비흡연자에서 발생하는 폐암의 유병률이 상대적으로 높은 아시아의 국가들에서는 어떠한 전략으로 폐암 검진을 진행해야 할지에 대한 근거가 되는 자료들은 부족한 상황이다. 본 연구는 분당서울대학교병원 건강검진센터에서 폐암 검진 목적으로 LDCT를 촬영한 17,968명의 비흡연자와 19,468명의 흡연자를 대상으로 하여 LDCT로 발견된 폐결절들의 유병률과, 이 결절들에서 실제 폐암 의심 하에 침습적인 조직검사를 시행하게 되는 비율, 폐암 진단율 및 임상경과를 비교 분석하였다. 그 결과, LDCT로 폐암검진을 시행할 때 비흡연자에서도 흡연자와 비슷한 비율 (16.2%)로 폐결절이 발견되며, 총 0.77%의 비흡연자가 폐암 의심 하에 침습적인 조직검사를 받았고, 0.47%가 폐암으로 진단을 받은 것으로 나타났다. 이 비율은 흡연자에 비해서는 낮았으나, 비흡연자에서 발견된 폐결절에 대한 침습적인 조직검사를 진행한 경우들을 분석해 보면 흡연자와 못지 않은 위험도로 비흡연자에서도 조직검사와 연관된 합병증과, 실제 암이 아닌 것으로 밝혀진 위양성 결과들이 발생함을 알 수 있었다. 본 연구결과는 특히 아시아 지역에서 LDCT로 폐암 검진을 받는 비흡연자에서 발견되는 폐결절에 대하여, 흡연자 못지 않은 정밀한 진단 및 치료전략이 필요함을 보여준다.
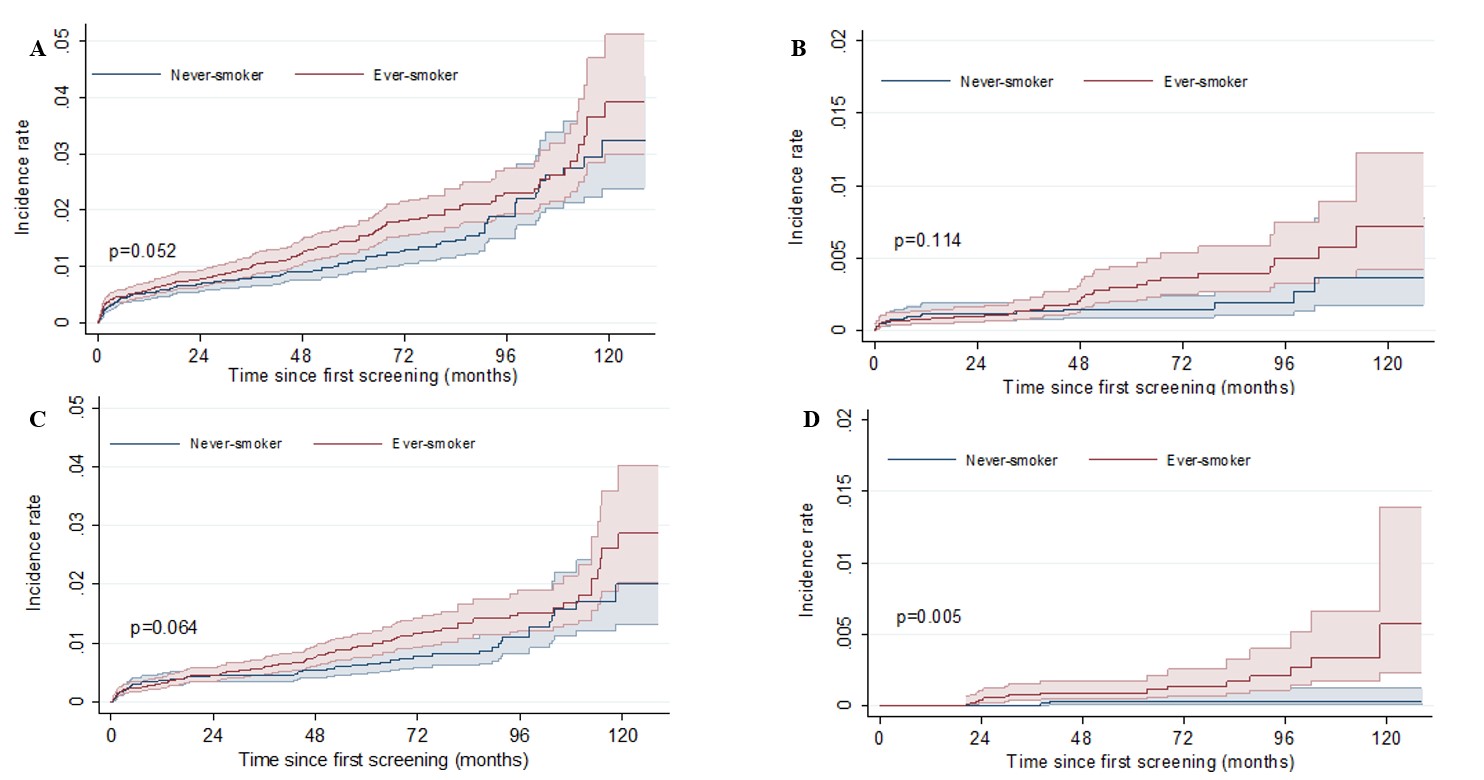
그림. 저선량 흉부 단층촬영으로 폐암검진을 받은 비흡연자 및 흡연자에서
(A) 침습적 조직검사, (B) 침습적 조직검사에 따른 합병증, (C) 폐암 진단, (D) 폐암관련 사망의 누적 발생률 비교
논문링크
https://erj.ersjournals.com/content/early/2020/05/29/13993003.00177-2020
Metastasis-on-a-chip reveals adipocyte-derived lipids trigger cancer cell migration via HIF-1a activation in cancer cells
Biomaterials, 2020

전양숙 교수(생리학교실)
암을 악화시키는 주요 원인으로 비만이 주목받고 있는 최근, 암 주위에 있는 지방세포와 암세포와의 상관관계를 밝히는 것이 중요해지고 있다. 지방세포에서 분비된 염증촉진인자 혹은 아디포카인들이 암세포의 성장 및 전이를 촉진한다고 알려져 있지만, 암 주위에 있는 지방세포에서 분비되는 지방산이 암 전이에 미치는 영향에 대해서는 연구가 미진하다.
암세포와 함께 공존하여 영향을 주고받는 암세포-지방세포 상호관계를 밝히고자, 의과대학 생리학교실 전양숙 교수팀(서지은 학생)은 이종세포의 3차원 공배양 기법을 통해 생체유사도가 높은 암 미세환경시스템을 구축하였다. 이 시스템을 이용하여 암 주위의 지방세포에서 분비되는 유리지방산이 암세포의 HIF-1alpha의 활성을 증가시킴으로써 암 전이가 촉진되는 새로운 기전을 밝혔다 (그림). 이 연구결과는 3차원 암 미세환경을 구현할 수 있는 in vitro 모델로서 3차원 PDMS 칩을 제시하였다. 본 기법은 암세포-지방세포뿐만 아니라, 다양한 이종 세포들의 공배양을 통해 이종 세포간의 상호관계를 밝히는데 활용이 가능할 것이라 기대된다. 또한, 암 전이 억제를 위한 새로운 표적으로서 지방산-HIF-1alpha 로 이어지는 신호전달 경로를 제시하였다.
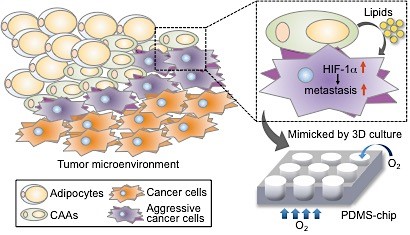
그림. 본 연구에서 구축한 3차원 암 미세환경 모델과 이를 통해 규명된 지방산-HIF-1a 신호전달 체계
논문링크
https://www.sciencedirect.com/science/article/pii/S0142961220308693?via%3Dihub
PLEIO: a method to map and interpret pleiotropic loci with GWAS summary statistics
Am J Hum Genet, 2020

한범 교수(의학과)
기초교실 한범 교수 연구팀은 여러 가지 만성질환을 동시에 일으키는 “핵심유전자”를 발굴하는 알고리즘을 개발했다. 하나의 유전자가 여러 가지 질병의 발현에 동시적으로 영향을 줄 수 있는데 이러한 유전자를 “다면발현 유전자 (pleiotropic locus)”라고 하며, 질병간 네트워크의 중심부에 위치해 있으므로 “핵심유전자”라고 부를 수 있다. 연구팀은 이 알고리즘을 사용하여 심혈관질환에서 중요한 역할을 하는 13개의 핵심유전자를 발견했다.
지난 15년간 다양한 만성질환에 대해서 질병을 일으키는 원인 유전자를 발굴하려는 시도가 전장유전체연관검색(GWAS)을 통해 이루어져 왔다. 하지만 이때까지의 연구는 각각의 질병을 따로따로 보았기 때문에 질병과 연관된 유전자가 가지는 복잡한 영향력을 이해하기 힘들었다. 따라서 최근 여러 가지 관련 질병을 하나로 묶어서 분석하는 네트워크 분석이 중요한 대안으로 주목받고 있다.
연구진은 질병 간 네트워크 분석을 통해 핵심유전자, 즉 다면발현 유전자를 높은 민감도로 식별할 수 있는 알고리즘 “플레이오(PLEIO)”를 개발했다. 플레이오는 여러 질병의 유전체 연구 결과들을 하나로 통합하여 분석하며, 질병 간 네트워크 관계를 고려하여 핵심유전자를 효과적으로 찾아낸다. 즉 유전체 수준의 다면발현 유전자 지도를 만들어 주는 것이다. 연구진은 심혈관질환과 관련 있는 18개의 특질들(심장병, 당뇨, 고혈압, 고지혈증, 비만 등)의 빅데이터를 분석하여 이 특질들에 동시적으로 영향을 끼치는 13개의 핵심유전자를 찾아냈다. 이 유전자들은 이때까지 심혈관질환 연구에서 전혀 보고되지 않은 새로운 유전자들이었다. 연구진은 이 새로운 알고리즘이 만성질환의 유전적 기전에 대한 이해를 높이는데 중요한 역할을 할 것으로 기대하고 있다.
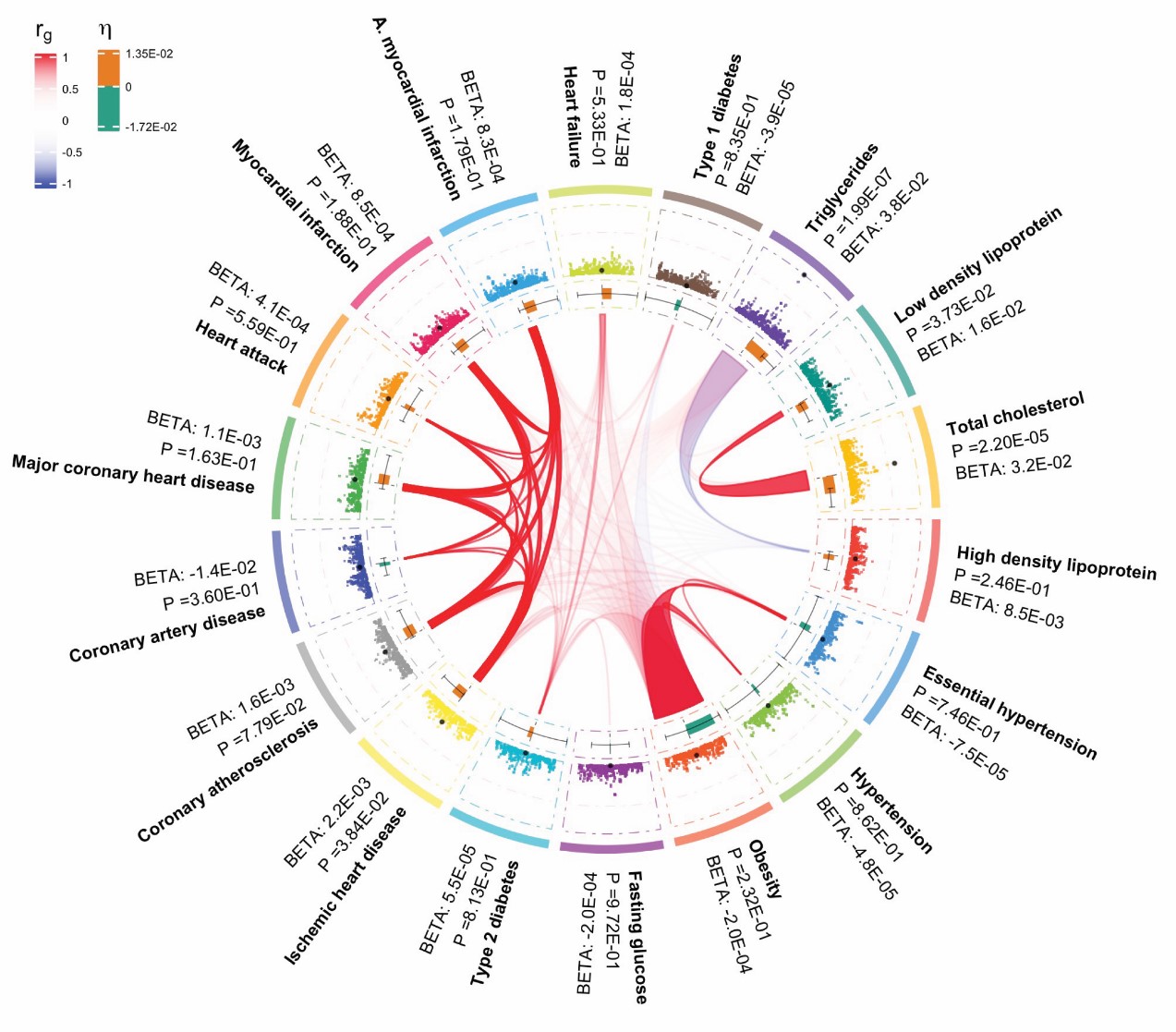
그림. 플레이오가 발굴한 핵심유전자가 18개의 심혈관질환 관련 특질에 어떻게 영향을 끼치는지 보여주는 네트워크 그림

