[연구동향]
CT Angiographic and Plaque Predictors of Functionally Significant Coronary Disease and Outcome Using Machine Learning
JACC Cardiovasc Imaging. 2020

구본권 교수(내과학교실)
관상동맥 협착으로 인해 발생하는 허혈성 심장질환은 의학뿐만 아니라 사회경제적으로 매우 중요한 질환이다. 따라서 관상동맥 협착으로 인한 혈류 공급의 정도를 평가하는 여러 지표들이 개발되어 임상에서 사용되고 있다. 그러나 아직까지 실제 환자에서 관상동맥 질환의 해부학적, 기능적, 및 형태학적 요소들 중 어떤 인자들이 심근허혈과 관련이 있으며 이들 인자들의 임상적 중요성에 대해서는 잘 알려져 있지 않다. 본 연구는 다국가 다기관 임상연구에서 추출한 관상동맥 CT조영술(CCTA)을 분석하여 1,013개의 혈관에서 얻은 정보를 machine learning기법을 통해 6개 주요 cluster를 추출한 후, 각 cluster에서 가장 영향력이 큰 지표를 선정하여 6개의 key features들을 선정하였다. 이 key features들은 이전 연구에서 찾아낸 지표들보다 심근허혈을 더 잘 예측하였으며 단순 해부학적 협착과 FFR을 이용한 conventional scheme에 비해 환자의 예후를 더 잘 구분할 수 있었다(AUC 0.706 vs. 0.611, p=0.031, 그림). 이러한 결과는 machine learning기법을 통해 수십 가지의 features들 중 허혈여부 및 환자의 예후를 예측할 수 있는 key features를 밝혀 냄으로써, 관상동맥 질환의 평가에 대한 새로운 패러다임을 제공하였다. 이 논문의 결과를 기반으로 현재 진행되고 있는 전향적 다기관 다국가 임상연구인 PRIME CT연구를 통해 이 패러다임의 임상적 유용성이 증명될 것으로 기대하고 있다.
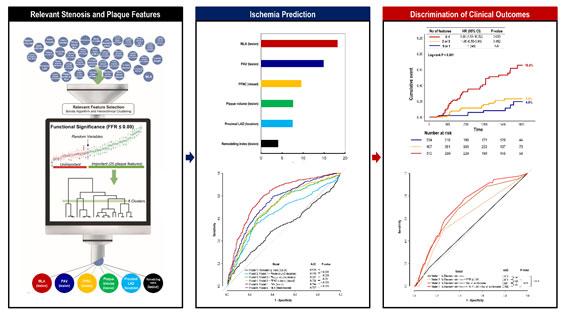
그림. Machine learning을 이용한 key feature selection 및 이의 임상적 효용성
논문링크
https://www.sciencedirect.com/science/article/pii/S1936878X20308111?via%3Dihub
Risk of Overcorrection in Rapid Intermittent Bolus vs Slow Continuous Infusion Therapies of Hypertonic Saline for Patients With Symptomatic Hyponatremia
JAMA Intern Med. 2021

김세중 교수(내과학교실)
혈중 나트륨 농도가 감소하는 저나트륨혈증이 생기면, 뇌세포의 수분이 증가하면서 뇌가 부어 두통•구토•경련•혼수상태를 유발할 수 있다. 이러한 저나트륨혈증 환자를 위한 신속하고 안전한 치료법에 대해 임상 증거가 불충분 하였는데, 이번 임상시험을 통해서 세계 최초로 저나트륨혈증 치료 방법을 확립하였다.
분당서울대병원 김세중(신장내과)•조유환(응급의학과), 서울시보라매병원 오윤규(신장내과), 한림대 동탄성심병원 백선하(신장내과) 등 3개 병원 응급실•병실에서 중증 저나트륨혈증이 발생한 환자 178명을 대상으로 무작위 배정 전향적 임상시험을 시행하였고, 그 결과를 미국의사협회 내과학 저널(JAMA Internal Medicine, 영향력지수 18.652)에 발표하였다.
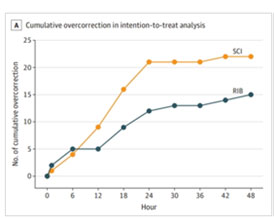
그림. 신속 간헐적 교정법(청색)과 완속 지속적 교정법(주황색)의 과교정 빈도 비교
중증 저나트륨혈증 환자는 초기에 혈중 나트륨 농도를 4~6 mmol/L만 높여도 환자의 증상을 호전시킬 수 있으나, 너무 많이 교정할 경우 탈수초증후군이라고 하는 심각한 부작용이 발생할 수 있기 때문에 적절히 교정하는 것이 매우 어렵다. 그동안 임상적으로 나트륨 교정수치를 추정한 복잡한 공식들을 사용하여 왔으나 그 정확도가 높지 않았다. 전통적으로 사용해온 3% 식염수를 소량씩 24시간 투여(완속•지속적 교정)하는 방법과, 3% 식염수를 20분간 (체중 X 2 ml/kg)을 6시간마다 간헐적으로 투여 (신속 간헐적 교정) 하는 방법을 비교하였다. 1시간 내 목표 나트륨 농도에 도달한 환자의 비율에서, 신속 간헐적 교정 방법이 완속•지속적 교정방법보다 1.8배 많았고, 혈중 나트륨 농도가 과교정되는 비율은 신속 간헐적 교정 방법이 완속 지속적 교정 방법의 72%에 그쳤다 (그림).
이번 임상시험이 저나트륨혈증 치료의 국제진료지침의 근거 수준을 높이는 랜드마크 연구가 될 것으로 보인다. 또한, 그동안 저나트륨혈증 교정치료 방법이 복잡하고 효과•안전성에 대한 근거가 미흡해 실제 임상에서 혼선이 많았는데, 체중 1㎏당 2㏄의 고농도 식염수를 20분 신속 투여하고 1시간 뒤, 이후에는 6시간 간격으로 혈액검사를 해 혈중 나트륨 농도가 목표 수준에 도달하고 유지되는지 모니터링하는, 간단하면서도 효과가 빠르고 안전한 교정치료 방법이 확립됨에 따라서, 의료진의 환자 관리도 훨씬 수월해질 것으로 전망한다.
논문링크
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2772353
Ketohexokinase-A acts as a nuclear protein kinase that mediates fructose-induced breast cancer metastasis
Nat Commun. 2020; 11(1): 5436.

박종완 교수(약리학교실)
점점 서구화되는 식습관으로 인해 과당의 섭취가 증가하고 있다. 과당에 의한 비만, 지방간, 당뇨 등 대사질환 발생은 잘 알려진 반면, 암에 대한 영향은 아직 불투명하다. 20여년 동안의 역학조사를 통해 과당의 소비와 암 발병과 정적 상관관계가 어느 정도 확인되고 있으나, 과당 과섭취가 암의 직접적인 원인인지 아니면 과당에 의한 대사질환이 원인인지 아직 명확하지 않다. 과당은 간에서 대사되어 에너지를 생성하며, 이 과정의 첫 번째 단계를 담당하고 있는 효소가 C형 Ketohexokinase(KHK-C)이다. KHK-C는 간, 신장, 소장 등에만 존재하는 국한적 효소이다. 이에 비하여 A형 Keto hexokinase(KHK-A)는 모든 장기에 존재하는 매우 보편적인 효소이지만 과당을 대사시키는 능력이 매우 부족하다. 왜 과당 대사도 잘 못하는 KHK-A가 이렇게 많이 존재할까? 이는 본 연구가 발표되기까지 하나의 미지수였다. 이번 연구를 통해, KHK-A는 과당을 인산화시키는 대사효소가 아니라, 단백질을 인산화시키는 생체신호전달자(signal transducer)로서 역할을 한다는 것을 새롭게 밝혔다. 본 연구에서는 과당이 암의 진행에 미치는 영향을 규명하고자, 모든 암세포에 존재하는 KHK-A에 주목하여 연구를 설계하고 유방암세포와 암이식 마우스를 이용하여 결과를 도출하였다 (그림 1).
과당에 의한 암전이 촉진의 기전을 요약하면 다음과 같다. 과당이 세포질에 있던 KHK-A를 세포핵 안으로 이동시키면, 핵 속에서 KHK-A가 YWHAH 단백질을 인산화하고, 인산화된 YWHAH가 SLUG 전사인자와 결합하여 활성화시킨다. 활성화된 SLUG는 암억제유전자인 CDH1의 프로모터에 결합하여 전사를 억제하게 되고 그 결과 암세포의 이동이 촉진되어 암전이가 발생된다 (그림 2).
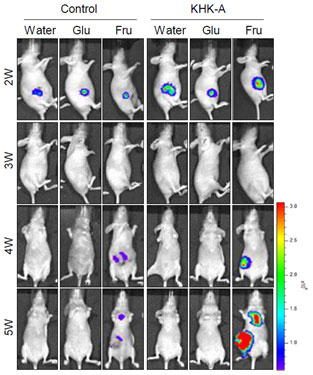
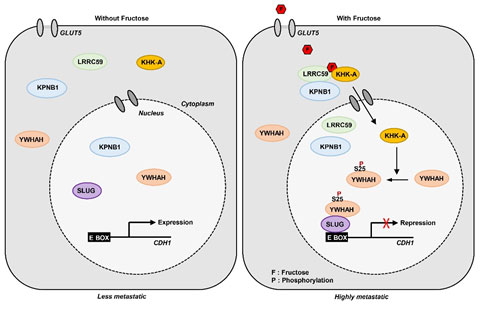
그림 2. 본 연구에서 규명된 ‘Fructose – KHK-A - YWHAH’신호전달 체계.
논문 링크
https://www.nature.com/articles/s41467-020-19263-1

