Journal of Experimental Medicine. 2020, June.
간 섬유화 원인 규명. 섬유화 치료제 개발 기대
김효수 교수(내과학교실)
간경변증, 폐섬유증, 만성신부전, 심근경색증 후 심부전 등은 대표적인 난치병들인데, 이들의 공통된 병인이 섬유화라는 것은 흔히들 간과하고 있다. 해당 장기 세포들이 사멸되어 섬유질로 대치 되면서 장기의 기능이 소실되는 것이 병태생리인데, 세계 유수의 연구실과 다국적 제약사들이 섬유화 세포의 활성이나 세포 사멸 후 야기되는 섬유화를 저지하기 위한 치료제 개발에 집중하고 있으나, 아직까지 치료제가 나오지 못하고 있다.
서울대학교병원내 보건복지부가 지원하는 ‘연구중심병원 프로그램의 바이오-치료제-개발 유닛’의 김효수-이은주 교수 연구팀은, 과거 5년 동안 중간엽-줄기세포가 간 손상을 치유하는 기전을 연구하면서, 간 섬유화를 억제하는 매스터 유전자, TIF1γ를 최근에 발견하였다. 즉, 중간엽 줄기세포치료에 의해서 간 섬유화가 억제되는 과정에서 작동하는 유전자를 규명하기 위해서, 먼저 섬유화의 기축 신호전달체계인 TGFβ에 의해서 감소하는(섬유화를 저지할) 유전자를 간-성상세포에서 검색하였다. 왜냐하면 간-성상세포가 간 섬유화를 지휘하는 세포이기 때문이다. 그 중에서 중간엽줄기세포의 처치에 의해서 증가하는 유전자를 검색한 결과 TIF1γ 유전자가 떠올랐다. 그리하여 이 유전자를 제작하여 사람 간-성상세포에 주입한 결과, 섬유화 유전자들을 차단하는 효과를 입증하였다. 나아가서 간-성상세포 특이적 TIF1γ 유전자 제거 조작 쥐를 만들어서, 간 손상을 부여했더니 대조군 마우스에 비해서 간 섬유화가 악화되는 현상을 확인하였다. 이러한 이론이 환자에게도 적용할 수 있을지 가능성을 보기 위해서, 간경변증 환자의 간 조직을 분석한 결과 TIF1γ의 발현이 정상인 간에 비해서 유의하게 낮음을 확인하였다. 간 손상 환자에게 TIF1γ 유전자 치료로써 간경변증을 예방하고 치료할 수 있는 길이 열린 셈이다. 이 결과들을 정리하여 Journal of Experimental Medicine에 보고하였다. 김효수 교수는 현재 TIF1γ 유전자를 간, 허파, 콩팥 섬유화를 치료하는 유전자 치료제로 개발하여 실용화시키기 위해서, 바이오 벤처 모-자 회사인 “Kim Cell & Gene”과 “Neo Gene Pharm”을 창업하였다. 여기서, 현재 TIF1γ 유전자 치료제를 최적화하여 공인된 동물실험기관에서 유효성을 재입증하면서 사람을 대상으로 한 1상 임상시험의 승인을 위한 자료를 구축하고 있다. 현재 개발중인 TIF1γ-유전자 치료제는, 간-성상세포에만 선택적으로 전달되면서, 간 손상 후의 간 섬유화 초래 환경하에서만 선택적으로 발현되도록 디자인되었기에, 안전하고 효율적인 것이 큰 장점이다. 다국적 제약회사들이 시도 중인 간 섬유 치료제 다른 후보들과 비교할 시에 우월하다. 앞으로 순도 높고 안정적인 유전자치료제를 대량 생산하는 공정을 확립한 이후, 동물실험에서 효과를 재증명해서 허가용 임상시험에 진입할 예정이다.
한편, 김효수/이은주 교수는 실용화에 있어 중요한 지식재산권 확보를 위해 논문 출판 전 특허 출원을 진행하였으며, 2020.05.07. 국내 특허 등록을 득하고, 각국 출원 준비 중에 있다.
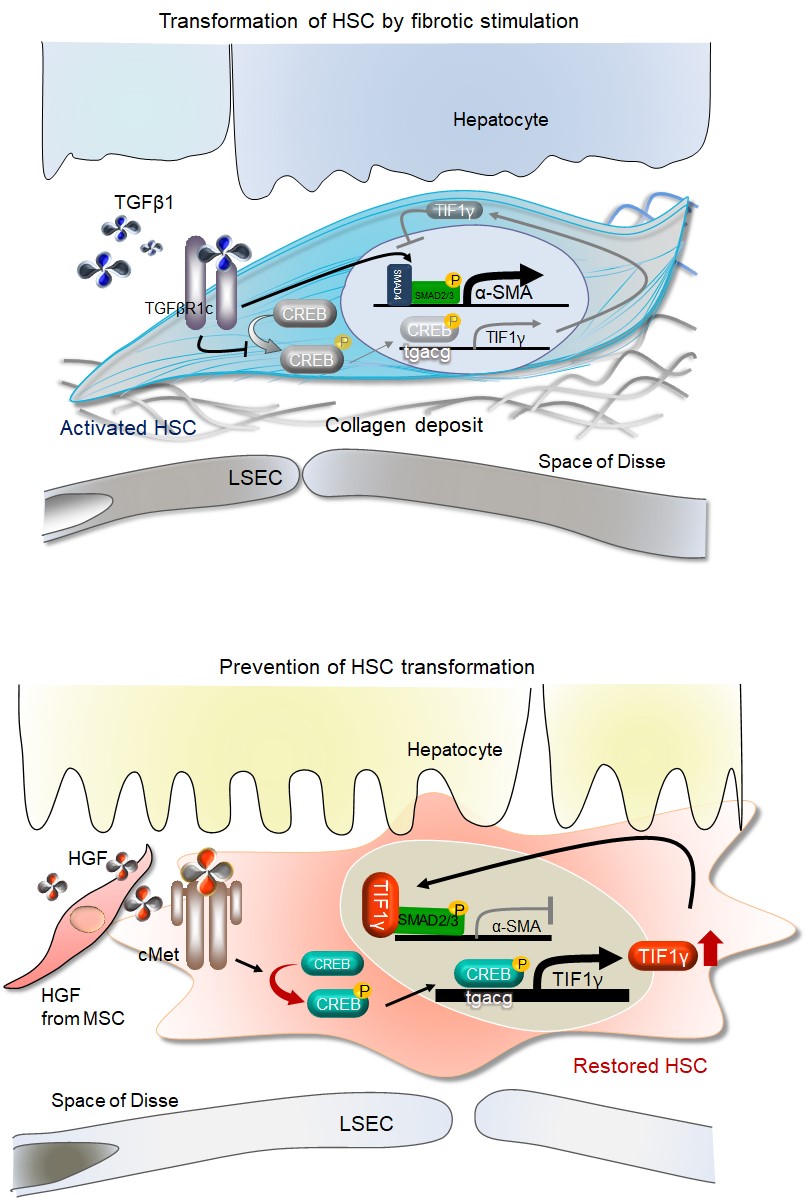
그림. 간 손상 후 간경변증으로 악화되는 과정에서, 새로 발굴한 TIF1γ 유전자의 역할.
[위] 간
손상 후 섬유화가 악화되는 기전. 간에
손상이 일어나면 간-성상세포에서 TGF-SMAD 신호가 발동하면서
(1)섬유화 유전자가 항진되며, (2)동시에 CREB의 인산화가 차단되어 TIF1γ 유전자가 감소함으로써 섬유화
유전자를 억제하지 못해서 간 섬유화 초래.
[아래] 반면 HGF (Hepatocyte Growth Factor)가 투여되면 cMET 수용체를 통해서 간-성상세포에서 TIF1γ 유전자가 유지된다. 그 결과 TIF1γ 단백질이 SMAD4를 대체하여 SMAD2/3와 결합함으로써 섬유화 유전자를 억제하여 간 섬유화를 예방.
- HSC = Hepatic Stellate Cell
- LSEC = Liver Sinusoidal Endothelial Cell
논문링크
Gastroenterology. 2020, June.


김희찬 교수(의공학교실) 김주성 교수(내과학교실)
다양한 의료 영상에서 진단의 보조 역할을 할 수 있는 인공지능 시스템이 개발되고 있다. 소화기 내시경 분야에서는 내시경 이미지로 대장 용종의 조직 병리를 예측하는 ‘광학 진단(optical diagnosis)’ 시스템의 개발이 활발히 이루어지고 있다. 대장 내시경 검사를 통해 발견된 용종을 내시경 이미지로 병리 소견을 예측할 수 있다면, 병리 검사에 소요되는 시간과 비용을 절감하고, 불필요한 조직 생검을 줄일 수 있다. 최근에는 인공지능 기술 중 하나인 딥러닝(Deep learning)기법을 이용한 컴퓨터 보조 진단의 광학 진단 정확도가 내시경 전문의 수준에 이르는 여러 연구들이 보고되고 있다. 그러나 아직까지 임상적으로 컴퓨터 보조 진단이 실제 임상에서 어떻게 활용 가능할지에 관한 연구는 없었다. 본 연구는 내시경 전문의와 인공지능 전문가의 공동 연구를 통하여 ‘대장 용종의 광학 진단 시스템’을 개발하였고, 이 시스템을 의사에게 적용하였을 때 광학 진단의 정확도 향상에 도움이 되는 것을 확인하였다. 이는 인공지능을 활용한 광학 진단 기술이 의사의 진단 정확도에 기여하여, 실제 임상에서 인공지능 시스템의 활용 가능성을 보여준 첫 번째 연구이다. (본 논문의 임상의학적 의미에 대해서는 Gastroenterology 저널의 Editorials [1]를 참고)
1) AutoML 방법을 이용하여 선행 CNN 방법보다 높은 진단 정확도의 알고리즘을 개발하였다.
(선행 CNN: 81.67%, AutoML: 85.33%, AutoML+Augmentation(제안하는 방법): 86.7%)
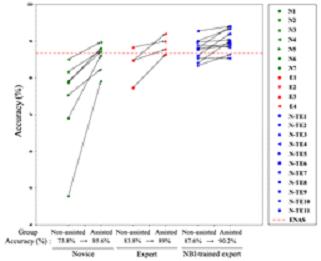
2) 숙련도 그룹별 (Novice, Expert, NBI-trained expert) 내시경 전문의가 AI 알고리즘의
진단 결과를 바탕으로 최종 진단을 했을 때, 정확도가 향상되었다.
(Novice: 73.8%→85.6%, Expert: 83.8%→89%, NBI-trained expert: 87.6%→90.2%)
3) NBI-trained expert 그룹 내시경 전문의가 AI 알고리즘의 진단 결과를 바탕으로 최종 진단을
했을 때, 진단 시간이 유의미하게 감소하였다. (4.44sec→3.68sec, p-val: 0.033)
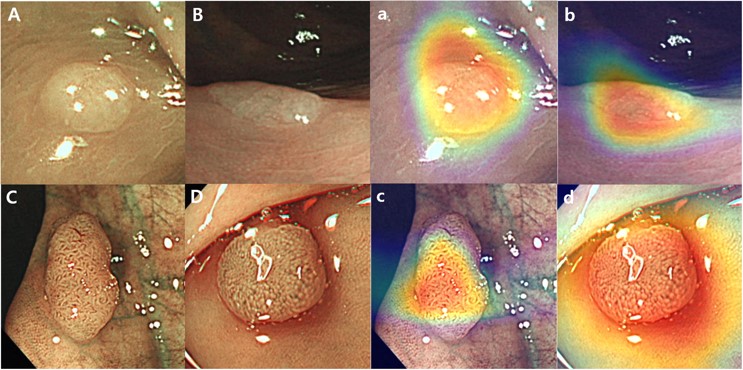
그림1 (좌) (A, B, C, D) 실험에 사용한 용종 예시 협대역 영상 원본, (a, b, c, d) 협대역 영상 원본에 heatmap 형태로 AI의 진단 근거를 시각적으로 띄워준 결과. 실험1에서는 내시경 전문의에게 협대역 영상 원본을 제시하였고, 실험2에서는 내시경 전문의에게 협대역 영상 원본과 heatmap 형태로 AI의 진단 근거를 시각적으로 띄워준 결과를 함께 제시함.
그림2 (우) 실험1과 실험2의 숙련도 그룹별 내시경 전문의의 진단 정확도 변화 그래프.
Reference
[1] MICHAEL F. BYRNE, “Hype or Reality? Will Artificial Intelligence Actually Make Us Better at Performing Optical Biopsy of Colon Polyps?” Editorials, Gastroenterology
Gut. 2020, March.

이정훈 교수(내과학교실)
만성 B형간염은 우리나라에서 가장 중요한 간경화 및 간암의 원인으로 항바이러스제를 이용하여 B형간염 바이러스(HBV)의 복제를 억제할 경우 HBV로 인한 반복적인 간 손상을 줄여서 간경화 및 간암의 발생 위험을 의미 있게 줄일 수 있다. 만성 B형간염에서 표면항원(HBsAg)이 없어지는 것을 ‘기능적 완치(functional cure)’라고 하며 이것이 현재까지 항바이러스제의 치료 목표로 간주되어 왔고, 미국 및 유럽 간학회에서는 이러한 경우 항바이러스제를 중단할 것을 권고하고 있다. 하지만, 이러한 환자들에게서 항바이러스제를 중단할 경우 바이러스의 재활성화 등의 우려가 있어 과연 약제를 중단한 사람과 지속적으로 투약한 사람 사이에 임상 결과의 차이가 있는지에 대한 연구가 필요한 상황이었다.
이에 서울대학교병원 소화기내과 이정훈 교수는 삼성서울병원, 아산병원, 신촌세브란스병원, 서울성모병원, 고려대학교병원 등 전국 16개 기관의 환자 데이터를 수집하여 HBsAg이 소실되고 6개월 이상 항바이러스제를 사용한 군(유지군)과 중단한 군(중단군)에서 재활성화(HBsAg 재발현) 비율, HBV DNA 재검출 비율, 및 간암 발생률을 비교하는 연구를 진행하였다. 총 276명의 환자 가운데 131명은 항바이러스제를 중단하였고, 145명은 항바이러스제를 유지하였는데, 항바이러스제를 중단한 군에서 HBsAg 재활성화율(위험도, 0.45; 95% 신뢰구간, 0.12–1.76, P=0.24; 그림 A), HBV DNA 재검출 비율(위험도 0.83, 95% 신뢰구간 0.16–4.16, P=0.82; 그림 B), 간암 발생률(위험도 0.53, 95% 신뢰구간 0.12–2.23, P=0.38; 그림 C) 모두 항바이러스제 유지군에 비해 유의한 차이를 보이지 않았다. 이에 따라 HBsAg이 소실된 환자에서 항바이러스제의 중단이 여러 임상적인 악화 위험을 더 높이지 않는다고 결론 내릴 수 있었으며 이는 전세계 최초의 연구 결과이다. 이는 만성 B형간염 환자에서 HBsAg이 소실되면 항바이러스제를 중단할 것을 권고할 수 있는 근거가 될 것이다.
이 연구 결과는 ‘영국 소화기학회지(Gut)’에 3월 25일자 온라인 논문으로 게재되었다.
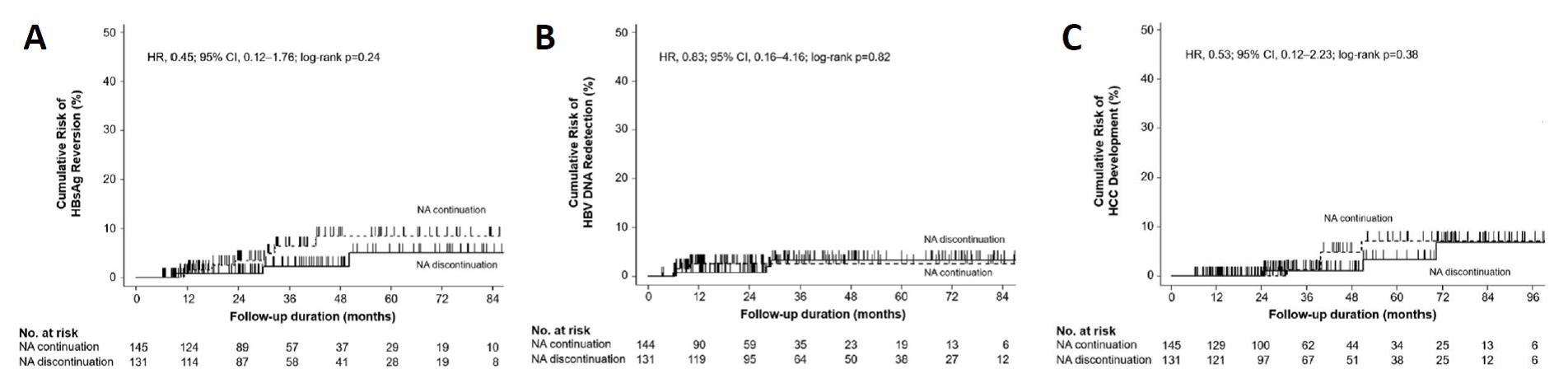
그림. HBsAg 소실 후 항바이러스제 중단군과 유지군의 (A) HBsAg 재발현, (B) HBV DNA 재검출, (C) 간암 발생 비율의 비교
논문링크