[연구동향]
Thermally drawn multifunctional all-hydrogel fibers for anti-fibrotic and multimodal neural interfaces
Advanced Materials

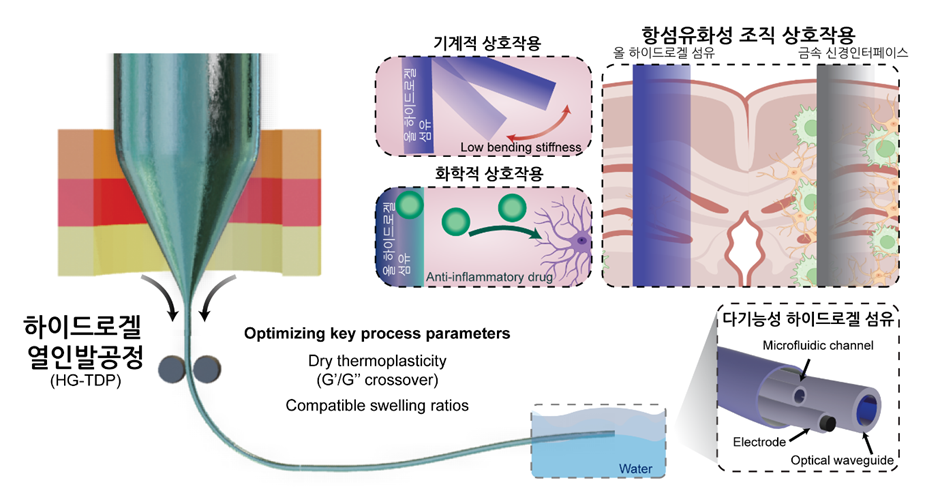
서울대학교 의과대학 의과학과 및 첨단융합학부 소속 박성준 교수 연구팀이 전극, 광섬유, 미세유체 채널을 모두 통합한 올 하이드로겔 기반 다기능성 신경섬유를 개발, 염증을 줄이고 생체조직과의 일체감을 높인 차세대 뇌-기계 인터페이스 구현에 성공했다.
이번 연구는 기존 삽입형 신경 인터페이스의 한계를 극복하기 위해 생체조직과 전자소자 간의 경계를 줄이고자 하는 접근에서 시작되었다. 체내 삽입형 신경 인터페이스는 뇌와 기계를 직접 연결해 신경 신호를 정밀하게 기록하고 자극할 수 있는 핵심 기술이다. 그러나 금속 또는 고분자 소재 기반의 장치는 생체조직과의 기계적, 화학적 불일치로 인해 삽입 직후부터 염증과 섬유화가 발생하며, 장기적으로 신호 품질이 저하되는 문제가 있었다.
이러한 한계를 해결하기 위해 연구진은 조직과 유사한 물성을 가진 하이드로겔 소재에 주목했다. 하이드로겔은 뇌조직과 유사한 탄성률을 지니고, 분자 투과성과 생화학적 변형이 가능해 신경세포와의 친화적 접촉을 구현할 수 있는 소재이다. 그러나 하이드로겔을 이용할 경우 다중 기능을 하나의 장치에 통합하기에는 제조상의 제약이 컸기에, 기존에는 전기적, 광학적, 화학적 기능 중 한 가지만 수행하는 단일 기능 장치의 개발에 연구가 머물러 있던 실정이었다. 이에 연구팀은 열 인발 공정이라는 새로운 방법을 이용, 전극, 광도파로, 약물전달 채널을 모두 하이드로겔로 제작하고, 이와 동시에 서로 다른 기능성 하이드로겔을 미세 정밀도로 집적하는 기술을 개발했다.
새롭게 개발된 다기능성 신경섬유는 전도성 하이드로겔, 투명한 광섬유 하이드로겔, 약물 방출용 미세유체 하이드로겔로 구성되어 있다. 이 구조는 조직과 유사한 연성과 생화학적 안정성을 유지하면서, 삽입 시 조직 손상과 염증 반응을 크게 줄이는 결과를 보였다. 또한 연구팀은 해당 디바이스가 단일 플랫폼에서 신경 신호 기록, 광 자극, 약물 전달을 모두 수행할 수 있어 뇌 기능의 정밀 제어가 가능함도 동물 실험을 통해 보였다.
이번 연구는 하이드로겔만을 이용한 신경탐침을 개발한 세계 최초의 사례로써, 생체적합성과 다기능성을 동시에 실현해 신경염증과 조직 손상 문제를 근본적으로 완화할 수 있는 새로운 전략을 제시했다는데 의의가 있다. 더불어, ‘스텔스 디바이스’가 뇌-기계 인터페이스 및 뇌신경조절 치료 분야 등에서 차세대 신경공학 기술 발전의 중요한 전환점이 될 것으로 기대된다.
Expansion of artificial intelligence for genome editing
Nature Structural & Molecular Biology

(생화학교실, 교신저자)

(의학연구원, 제1저자)
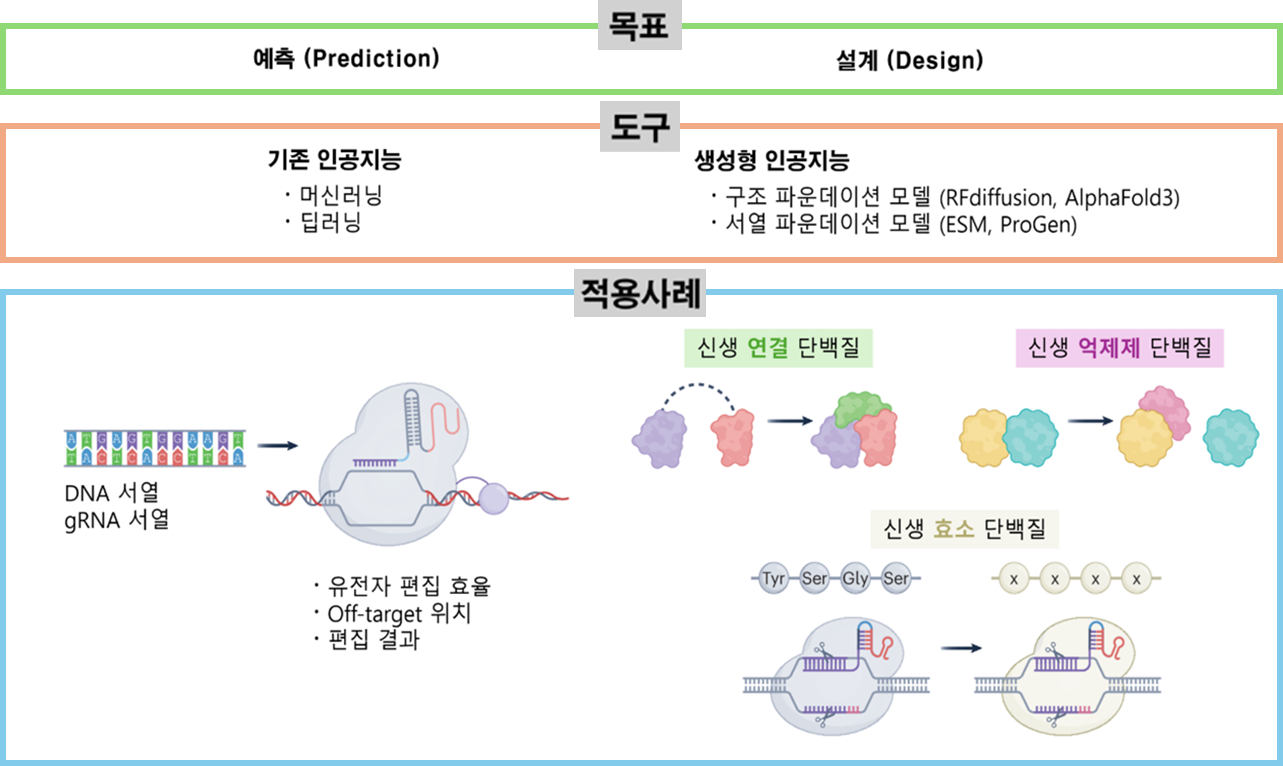
본 연구는 생성형 인공지능(generative AI)이 유전체 편집 기술을 ‘예측(predictive)’ 수준에서 ‘설계(design)’ 단계로 확장시키고 있음을 조망한 논문으로, Nature Structural & Molecular Biology에 News & Views 형식으로 게재되었다.
본 논문에서는 기존의 머신러닝, 딥러닝 기반 유전자 편집 효율 및 off-target 예측을 넘어, RFdiffusion, AlphaFold 3, ESM 등과 같은 생성형 AI 기반 파운데이션 모델이 단백질 구조와 기능을 de novo로 설계함으로써 새로운 유전체 편집 도구를 창출할 수 있는 최신 동향을 종합적으로 분석하였다. 특히, AI 기반 단백질 설계를 통해 기존 생물학적 진화 과정으로는 얻기 어려운 새로운 효소 및 보조 단백질들이 본격적으로 개발되고 있음을 제시하였다. 실례로, 최근에 개발된 새로운 Cas9 단백질, 고효율의 프라임교정 기술, 높은 정확도의 미토콘드리아 염기교정 기술 등을 소개하였다.
유전체 편집 분야에서 생성형 AI가 단순 보조 도구를 넘어 새로운 ‘설계자’로 기능할 수 있음을 처음으로 조망하였으며, 향후 기초 연구뿐 아니라, 차세대 유전자 치료, 정밀 의학 등에 널리 활용될 것으로 전망된다.
Direct crosstalk between GPCRs and ion channels via G proteins
Experimental & Molecular Medicine

(생리학교실, 공동교신저자)

(의과학과, 공동제1저자)
GPCR-이온 채널 상호작용의 분자적 이해: G 단백질의 직접 조절 메커니즘을 중심으로
세포 신호 전달의 핵심 구성 요소인 이온 채널은 다양한 외부 및 세포 내 자극에 반응하여 이온 투과를 조절하며, 세포 항상성 유지에 결정적인 역할을 한다. 이러한 이온 채널의 활성은 G 단백질 연결 수용체(GPCR) 신호 전달 경로에 의해 정교하게 조절된다. 기존에는 GPCR 활성화로 인한 이차 전령 물질을 통한 간접적인 이온 채널 조절이 주로 알려졌으나, 최근 연구들은 Gα 또는 Gβγ 소단위체가 이온 채널에 직접 결합하여 활성을 조절하는 메커니즘이 중요하게 부각되고 있다.
본 리뷰 논문은 G 단백질과 이온 채널 간의 직접적인 상호작용을 다룬 최신 cryo-EM 구조 연구들을 종합적으로 정리함으로써 이 분야의 분자적 이해를 심화하였다. 특히, G 단백질 소단위체(Gα, Gβγ) 및 small G protein의 구조적 특징을 소개하고, 이들이 GIRK2, TRPM3, TRPC5, TRPV4와 같은 주요 이온 채널과 형성하는 복합체 구조와 기능 조절 메커니즘을 중점적으로 분석하였다.
1. GIRK2-Gβγ 복합체: GIRK2 채널은 심장 및 신경 세포 조절에 필수적이며, PIP₂, Na⁺, 그리고 Gβγ에 의해 부분적으로 활성화된다. cryo-EM 구조 분석 결과, Gβγ 결합은 세포질 도메인(CTCD)의 회전과 막 관통 도메인(TMD)의 부분적 열림을 유도하여 채널 활성화를 이끌어내었다. KCTD와 Gβγ의 높은 결합 친화도는 GIRK2 채널의 탈감작을 유도하는 중요한 조절 메커니즘으로 제시된다.
2. TRPM3-Gβγ 복합체: TRPM3는 기존에 여러 리간드와 열에 의해 조절된다고 알려져 있었으나, Gβγ가 직접 결합하여 채널을 활성화시킨다는 새로운 조절 메커니즘이 밝혀졌다. Gβγ는 TRPM3의 exon 17 영역에 있는 Gβ-결합 부위에 결합하며, PIP₂가 존재할 때 Gβγ가 세포막 쪽으로 이동하며 추가적인 접촉들이 형성된다.
3. TRPC5-Gαi3 복합체: Gα 소단위체 중 Gαi3가 TRPC5 채널과 직접 결합하여 조절한다는 점은 이온 채널과 Gα 간의 직접적인 상호작용을 보여주는 중요한 사례이다. Gαi3는 TRPC5의 세포질 안키린 반복 도메인(ARD)에 결합하며, N-말단이 풀려 ARD에 도달하여 결합하는 모델이 제시되었다. TRPC5의 IYY 모티프와 Gαi3의 특정 잔기들 간의 상호작용이 밝혀졌고, Gαi3 결합은 TRPC5의 PIP₂ 민감도를 증가시켜 채널 활성화를 촉진한다.
4. TRPV4-RhoA 복합체: RhoA를 포함한 small G protein은 세포 이동 등 생리학적 과정에 중요하며, 최근 TRPV4-RhoA 복합체의 cryo-EM 구조가 규명되었다. RhoA는 TRPV4의 N-말단 ARD에 있는 특정 영역(AR2–AR5)과 결합하여 채널의 활성을 억제한다. TRPV4가 활성화되어 열린 상태에서는 RhoA와의 결합이 약화되는데, 이는 RhoA가 TRPV4 ARD의 상향 움직임을 기계적으로 제한하여 채널 활성을 억제하는 tonic inhibitor 역할을 수행함을 시사한다.
이 외에도 TRPM1, CaV 채널 등 다양한 이온 채널에서 Gα 또는 Gβγ 소단위체의 직접적인 조절 가능성이 논의되었다. 또한 small G protein들은 TRP 채널과 상호작용하여 소포 수송, 세포 이동 등 다양한 세포 과정에 관여하며, 때로는 positive feedback loop를 통해 질병 발생에 기여하기도 한다.
결론적으로, 이 리뷰는 G 단백질이 GPCR의 신호 전달을 넘어 이온 채널과 직접 상호작용하여 기능을 정교하게 조절하는 분자적 메커니즘에 대한 심층적인 이해를 제공하였다. G 단백질 결합 이상으로 인한 채널병증(channelopathies) 발생 가능성과 이온 채널의 N-말단 영역에 많은 질병 관련 변이가 집중되어 있다는 점은, G 단백질-이온 채널 단백질-단백질 상호작용을 조절하는 것이 향후 약물 개발의 잠재적 목표가 될 수 있음을 시사한다. 아직 해결되지 않은 질문들(G 단백질 결합 시 이온 채널의 형태 변화 유도 방식, 협동성, 다른 조절인자와의 상호작용, GPCR-이온 채널 메가콤플렉스 형성 가능성)에 대한 추가적인 구조적 및 기능적 연구가 필히 요구된다.

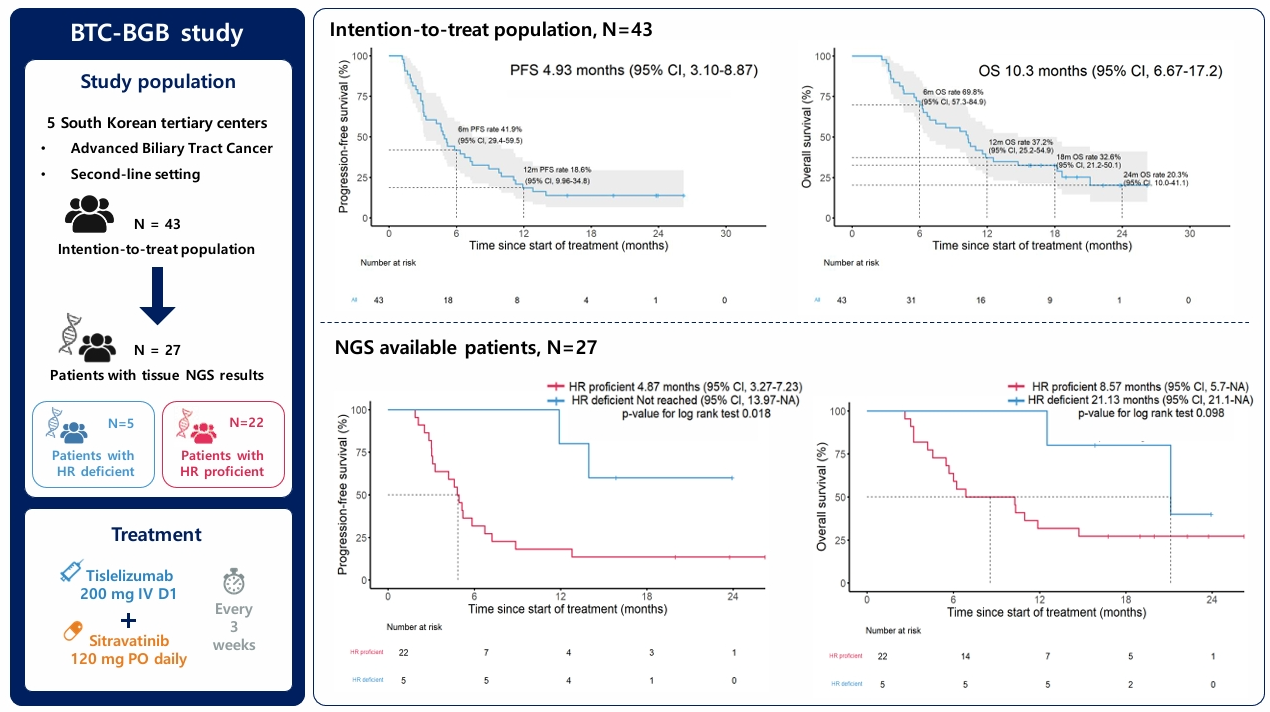
Open-label, single-arm, phase 2 trial to investigate the efficacy of sitravatinib plus tislelizumab combination as a second-line treatment for advanced biliary tract cancer
Journal of Hepatology

(내과학교실, 교신저자)

(내과학교실, 제1저자)
담도암은 전 세계적으로는 상대적으로 발생 빈도가 낮은 암종이지만, 국내에서는 연간 7,500명 정도가 새로 진단되고 있어 이는 전 세계적으로 발생률이 매우 높은 수준에 해당한다. 약 70%가량의 환자가 진단 시 진행 병기로 진단되고, 고식적 항암치료에도 불구하고 전체 생존기간이 약 12개월로 보고된 예후가 나쁜 암종이다.
이번 연구는 진행성 담도암 환자에서의 2차 치료로 anti-angiogenic agent인 sitravatinib과 anti-PD-1 inhibitor인 tislelizumab의 병용 요법의 안전성 및 효과를 평가한 국내 다기관 2상 임상 연구로, 무진행 생존기간 4.93개월, 전체 생존기간 10.3개월로 세포독성항암제 없이 표적치료제/면역항암제 조합만으로 고무적인 성적을 보고하였고, 부작용측면에서도 관리 가능한 부작용 프로파일을 보였다. 또한, 치료 효과는 이전 면역항암제 치료 여부와 무관하게 모든 환자에서 관찰되었으며, 특히 암 조직을 이용한 NGS 검사 상 상동 재조합 결핍 (homologous recombination deficiency)가 확인된 환자에서 상동 재조합 결핍이 없는 환자에 비해 우수한 효과를 보임을 확인하였다.
이번 연구는 면역항암제가 진행성 담도암의 1차 치료로 자리잡은 이후, 2차 치료로의 면역항암제 반응성을 평가한 첫 논문으로 의미가 있으며, 적절한 바이오마커로 환자를 선정하면, 여전히 면역항암제를 이용한 치료 전략이 환자에게 큰 혜택이 있을 수 있음을 제시하였다.
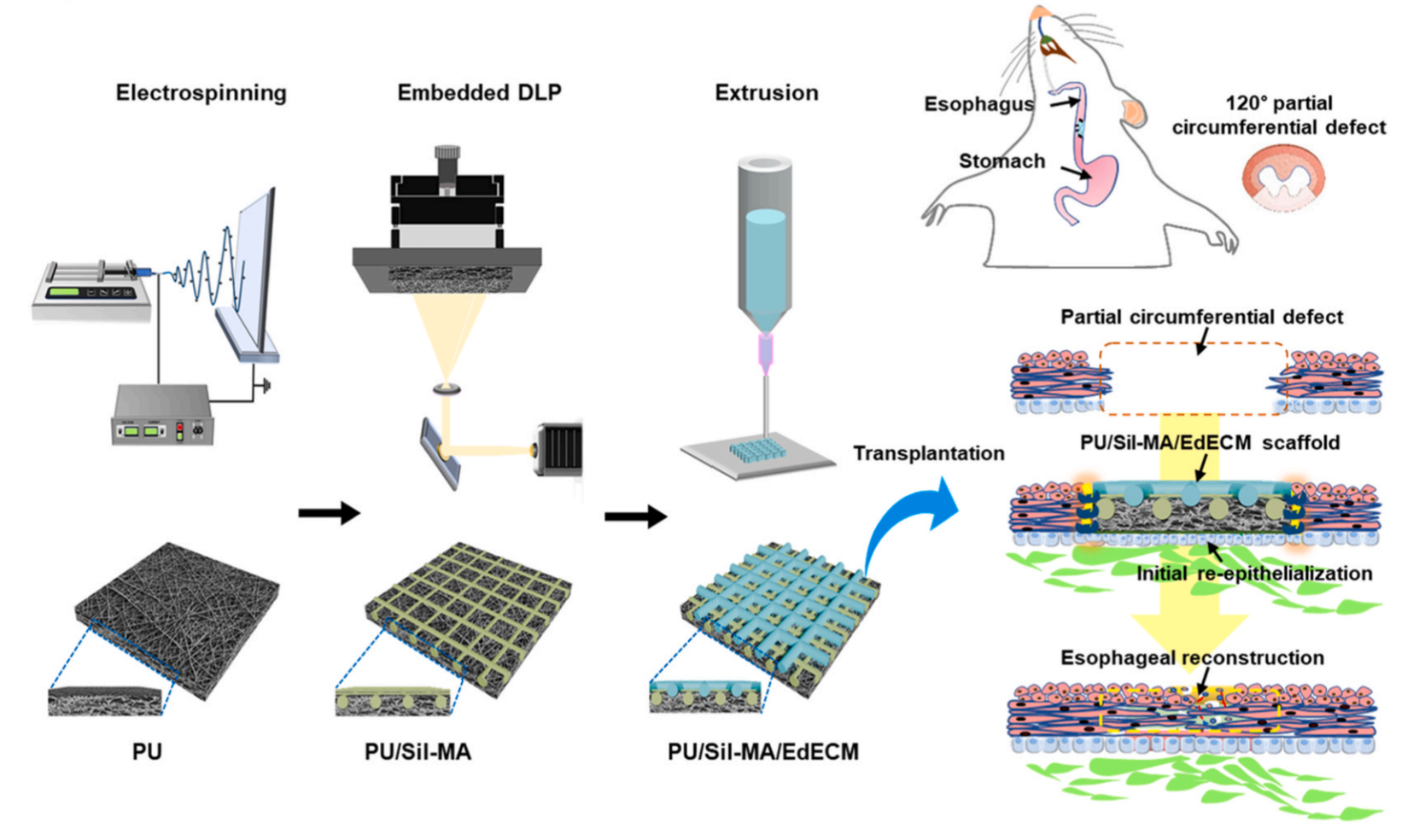
Integrated biofabrication of artificial esophageal scaffolds using electrospinning, embedded DLP, and extrusion techniques
Materials Today Bio

(이비인후과교실, 공동교신저자)

(서울대학교병원 이비인후과,
공동제1저자)
서울대학교 의과대학 정은재 교수 연구팀은 국립부경대학교 의공학전공 남승윤 교수 연구팀과 공동으로 식도 재건을 위한 인공식도 제작용 융합 바이오제조 기술을 개발했다.
이번 연구는 전기방사, 임베디드 DLP, 압출 바이오프린팅 기술을 하나의 공정으로 결합해 생체조직의 구조적·기계적 특성을 동시에 구현할 수 있는 통합 플랫폼을 제시했다는 점에서 주목받고 있다.
식도 질환이나 손상으로 인한 결손은 현재 위나 대장을 이용한 이식수술로 재건하는 방법이 주로 사용되고 있으나, 기계적 특성 불일치와 염증 반응, 연동운동 저하 등 여러 합병증이 발생하는 한계가 있었다. 이에 정은재 교수팀은 생체적합성과 기계적 안정성을 동시에 확보할 수 있는 차세대 인공식도 지지체를 개발했다.
연구팀은 먼저 전기방사를 통해 탄성과 내구성이 뛰어난 나노섬유를 제작한 뒤, 미세구조 내부에 실크피브로인을 광경화 방식으로 패턴화하여 구조적 강도와 친수성을 향상시켰다. 이어 식도유래 탈세포화 세포외기질을 정밀 압출 프린팅으로 적층하여 식도조직과 유사한 미세환경을 구현했다.
연구 결과, 복합 인공식도 스캐폴드는 인장강도와 탄성률이 크게 향상되었으며, 줄기세포 부착과 증식, 평활근 및 상피세포 재생능이 뚜렷하게 개선됐다. 또한 쥐 식도 결손 모델에 적용한 동물실험에서는 스캐폴드가 숙주조직과 원활히 융합되며 염증 반응이 줄었고, 신경 및 혈관 재생과 연동운동 회복이 확인되어 실제 식도 기능 복원이 가능함을 입증했다.
정은재 교수는 “이번 연구는 전기방사, 광가교, 압출기반 바이오프린팅을 단계적으로 결합하여 식도의 복잡한 구조와 기계적 특성을 동시에 구현한 첫 사례”라며, “단일 공정에서 기계적 강도·친수성·조직재생을 정밀 제어할 수 있는 새로운 바이오제조 전략을 제시한 데 의의가 있다”고 밝혔다.
이번 연구 결과를 담은 논문 ‘Integrated Biofabrication of Artificial Esophageal Scaffolds using Electrospinning, Embedded DLP, and Extrusion Techniques’는 생체재료 분야 최우수 국제학술지 Materials Today Bio (IF 10.2, JCR 상위 7.2%) 온라인판에 최근 게재됐다.