[연구동향]
Meter-scale heterostructure printing for high-toughness fiber electrodes in intelligent digital apparel
Nature Communications

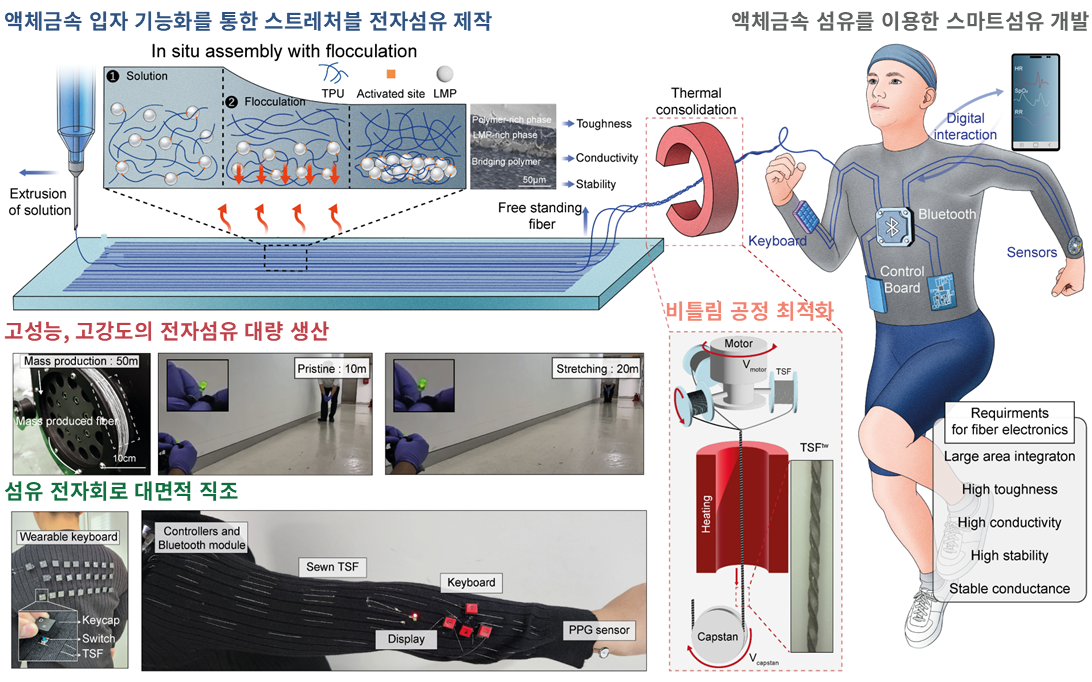
서울대학교 첨단융합학부/의과대학 의과학과 소속 박성준 교수와 연구팀[이건희 박사(현 부산대학교 교수), 이윤흠 박사과정, 서현엽 박사과정]이 액체금속 복합체 기반의 50미터급 신축성 전자 섬유를 연속 생산하고, 이를 실제 착용 가능한 헬스케어용 스마트 의류로 구현하는 데 성공했다.
전자섬유는 사용자 친화적인 웨어러블 소자와 헬스케어 기기의 핵심 소재로 주목받아 왔지만, 기존 섬유형 전극은 인체의 움직임에 취약해 내구성과 전기적 안정성이 부족하다는 한계가 있었다. 이를 극복하기 위해 최근에는 기계적 변형에 유연하게 대응할 수 있는 액체금속(liquid metal, LM) 기반 전도성 소재가 연구되고 있으나, 누액(leakage) 위험과 대면적 생산의 어려움으로 실제 의류 적용에는 한계가 있었다.
연구팀은 이러한 문제를 해결하기 위해 액체금속(liquid metal particle, LMP)를 기능화된 고분자(thermoplastic polyurethane, TPU)로 감싸는 복합화 기술을 개발했다. 특히 고출력 소니케이션(sonication)을 이용해 고분자 사슬의 말단을 화학적으로 활성화하고, 입자 간 물리적 응집을 유도해 자연스러운 상분리(flocculation) 구조를 형성했다. 그 결과, 전도성 영역과 기계적 지지 영역이 이중 구조로 분리된 섬유가 완성돼 누액 없이 안정적인 전도성과 뛰어난 강인성(toughness), 신축성을 동시에 확보할 수 있었다.
또한 연구팀은 이렇게 제작된 섬유 여러 가닥을 정밀하게 꼬아내는 비틀림 섬유(twisted structured fiber, TSFtw) 구조를 도입, 실제 봉제가 가능할 정도의 두께와 기계적 강도를 확보했다. 이를 통해 옷감 위에 바느질하듯 전자섬유를 통합할 수 있었으며, 전원, 센서, 처리 모듈 등 다양한 전자 부품을 안정적으로 연결해 운동 중에도 끊김 없는 작동을 구현했다.
개발된 섬유는 얇고 유연하면서도 세탁, 강한 스트레칭, 반복적인 꺾임에도 성능을 유지하며, 의료용 스마트 의류, 웨어러블 인터페이스, 디지털 제어 장치 등 다양한 응용 가능성을 지닌다. 연구팀은 실제로 이 섬유를 이용해 심박 측정 센서, 무선 키보드, IMU (inertial measurement unit) 기반 모션 트래커, 인터랙티브 디스플레이가 통합된 디지털 의류를 제작하고, 일상 환경에서의 안정적인 작동을 실험적으로 입증했다.
이번 연구는 기능성 섬유 전극을 산업 규모로 생산할 수 있을 만큼 성능과 안정성을 확보한 사례이며, 섬유에 전도성과 유연성을 동시에 부여함으로써 실제로 입고 사용할 수 있는 전자기기, 즉 ‘입는 컴퓨터(wearable computer)’를 실현하는 데 기여할 수 있을 것으로 기대된다.
Autophagy induction enhances homologous recombination-associated CRISPR–Cas9 gene editing
Nucleic Acids Research

(생화학교실, 공동교신저자)

(해부학교실, 공동교신저자)

(유전체의학연구소, 공동제1저자)
본 연구는 서울대학교 의과대학 생화학교실, 해부학교실 연구팀과 한국화학연구원 남혜진 박사 연구팀이 공동으로 수행한 연구로 오토파지 현상의 유도를 통하여 성공률이 낮은 상동재조합에 의한 유전자 정밀 편집의 효율을 개선시킨 연구이다.
유전자 가위(CRISPR-Cas)는 gRNA에 의해 인식되는 타겟 DNA 서열을 정확하게 잘라 유전자를 교정할 수 있는 기술이다. 다만 타겟 DNA 서열 절단 이후 DNA 복구 과정은 대부분 부정확한 방식의 비상동말단결합(NHEJ)에 의해 이루어진다. 유전자를 정밀하게 교정하거나 새로운 유전정보를 도입하기 위해서는 상동재조합(HR)에 의한 유전자 교정이 필요하나 이는 세포 내에서 매우 낮은 효율로 나타난다.
본 연구팀은 오토파지, 즉 세포 내 자가포식 현상에 의한 재활용 과정이 상동재조합 기작의 유전자 교정효율에 영향을 미칠 수 있음에 주목하고 오토파지를 유도할 수 있는 영양결핍상태를 유도하거나 오토파지 유도제를 처리함으로써 상동재조합에 의한 편집효율이 약 3배 가량 증가하는 것을 확인하였다. 나아가 오토파지 조건에서 Cas9 주위에 모여드는 단백질들을 분석함으로써 상동재조합 기작과 관련한 다양한 단백질들을 포착할 수 있었다.
이러한 현상이 세포 수준을 넘어 유전자 치료에 적용할 수 있을지 검증하기 위하여 생쥐의 망막색소 상피 조직에서 실험을 진행한 결과, 오토파지 유도제에 의한 생체 내 유전자 도입 효율 증가를 확인하였다. 또한 청각장애 유발 유전자인 MPZL2 변이를 보유한 환자 유래 세포에도 오토파지 유도에 의한 교정 효율 증가를 확인할 수 있었다.
오토파지 현상을 이용한 상동재조합의 효율 증대는 정밀 유전자 교정의 효율을 높여 향후 희귀 유전질환 치료에 널리 이용될 수 있을 것으로 기대된다.


Proteogenomic characterization of molecular and cellular targets for treatment-resistant subtypes in locally advanced cervical cancers
Molecular Cancer

(해부학교실/의과학과,
공동교신저자)

(의과학과/의학연구원,
공동제1저자)
국소 진행성 자궁경부암(locally advanced cervical cancer, LACC)은 진단 시점에서 이미 종양이 자궁경부 주변 조직으로 침윤한 상태로, 표준 치료 후에도 재발과 치료 저항의 위험이 높은 고위험 암종이다. 특히, 병리학적 분류만으로는 예후나 치료 반응을 정확히 예측하기 어려워, 정밀한 분자 수준의 이해와 새로운 치료 타깃 발굴이 시급한 상황이다.
본 연구에서는 국소 진행성 자궁경부암에 대한 proteogenome 분석을 수행하여 초기 단계 자궁경부암과 비교했을 때, squamous LACC에서는 keratinization-TP53 조절 경로가, adeno-LACC 에서는 O-glycosylation-TP53 조절 경로의 변화가 두드러짐을 밝혔다. mRNA, 단백질 그리고 인산화 단백질 데이터를 integrated clustering하여 분석한 결과 LACC는 총 6가지 subtype (Sub1~6)으로 구분되었으며, 이 중 Sub3, Sub5, Sub6는 치료 저항성이 높고 local recurrence-free survival이 낮은 subtype으로 나타났다. 면역 활성과 extracellular matrix (ECM) 활성 증가가 관찰된 Sub3는, PDGFD+/CXCL1+ cancer-associated fibroblast (CAF)에 의해 매개되는 활발한 기질 반응이 특징이며, MUC5AC를 많이 발현하는 상피세포가 풍부하게 존재하는 면역 활성이 높은(immune-hot) subtype이다. 반면, Sub5는 epithelial-mesenchymal-transition (EMT) 및 ECM 리모델링이 증가되어 있으며, PGK1 및 CXCL10을 많이 발현하는 상피세포가 풍부한 면역 활성이 낮은(immune-cold) 편평세포 subtype임이 밝혀졌다. 또한, CIC mutations이 ETV4의 발현을 통해 EMT를 유도할 수 있고, immune checkpoint PVR의 발현 증가와 neutrophil-like myeloid-derived suppressive cells (FCN1 및 FCGR3B를 많이 발현하는 macrophages)의 존재가 T 세포 활성을 억제할 수 있음을 증명하였다. 더 나아가, Sub6는 O-linked glycosylation mucin의 증가가 그 특징으로 밝혀졌다.
이러한 결과들은 치료 저항성을 갖는 LACC subtype을 예측하고, 해당 subtype들을 표적으로 삼을 수 있는 somatic mutations, cellular pathways 그리고 cellular players 와 같은 유효 타깃들을 제공하여 난치암에 대한 환자 맞춤형 치료 전략 수립의 근거를 제공하게 되었다. 특히 Myeloid 면역 조절을 활용한 혁신적 치료 전략도 제안하게 되었다.


