[연구동향]
Effects of Patient-Driven Lifestyle Modification Using Intermittently Scanned Continuous Glucose Monitoring in Patients With Type 2 Diabetes: Results From the Randomized Open-label PDF Study
Diabetes Care. 2022

조영민 교수
(내과학교실, 교신저자)
당뇨병은 인슐린 분비세포 파괴로 인해 인슐린이 분비되지 않는 1형과 인슐린은 분비되나 양 또는 작용에 문제가 있는 2형으로 구분된다. 생활 습관 교정을 기본으로 하는 2형 당뇨병과 달리, 1형 또는 심한 2형 당뇨병은 인슐린 치료가 필요해 하루에도 수 차례 주사를 맞아야 한다. 이러한 1형 또는 심한 2형 당뇨병 치료는 신체에 부착하면 실시간으로 혈당을 측정해주는 ‘연속혈당측정기’의 등장으로 혁신을 맞이했다. 이 기기를 사용하면 식사·수면 중에도 혈당을 자동으로 측정할 수 있어 혈당 조절이 매우 유용하다. 그러나 하루에 1회만 인슐린 주사를 맞거나 아예 맞지 않는 일반적인 2형 당뇨환자에서는 연속혈당측정기의 효과와 안정성이 밝혀지지 않았고, 기기의 혈당데이터를 해석·적용하기 위한 교육도 복잡해 환자가 실생활에서 사용하기 어려웠다. 서울의대 내과학교실 조영민 교수가 이끄는 연구팀은 연속혈당측정기 데이터를 쉽게 해석·적용하기 위해 ‘식후 혈당을 눈으로 확인해 건강에 나쁜 음식을 스스로 평가한다’는 뜻의 ‘SEOUL* 알고리즘’을 개발했다 (SEOUL: Self-Evaluation Of Unhealthy foods by Looking at postprandial glucose).
SEOUL 알고리즘은 ‘일반적으로 건강에 좋다고 알려진 음식인가?’, ‘이 음식을 먹고 혈당이 많이 올랐는가?’라는 단 2가지 항목만 평가한다. 모든 평가는 어떠한 기준 없이 환자의 상식에 따라 주관적으로 이뤄진다. 이 간단한 알고리즘을 따른다면 환자는 적절한 혈당 수준에서 건강한 식사를 할 수 있고, 식후 혈당 상승을 유발하는 해로운 식사는 피할 수 있다. 연구팀은 2형 당뇨환자 126명을 SEOUL 알고리즘·연속혈당측정기 사용 그룹과 비사용 그룹(대조군)으로 각각 63명씩 구분하고, 12주 동안 환자 스스로 혈당을 측정하도록 했다. 12주 후 두 그룹을 비교한 결과, 연속혈당측정기 그룹(-0.6%)이 대조군(-0.1%)보다 평균 당화혈색소(HbA1c) 수치 감소폭이 컸다. 당화혈색소 수치 7% 미만에 도달해 혈당 조절 목표를 달성한 비율도 연속혈당측정기 그룹(24.1%)이 대조군(8.1%)보다 크게 높았다. 뿐만 아니라, 12주 후 평균 체중이 0.1kg 증가한 대조군과 달리 연속혈당측정기 그룹은 평균 체중이 1.5kg 감소했고, 공복 혈당 수치는 연속혈당측정기 그룹(136mg/dL)이 대조군(154mg/dL)보다 낮은 것으로 나타났다. 즉, 2형 당뇨병 치료에 있어서 환자 스스로 생활습관을 조정하는 SEOUL 알고리즘과 연속혈당측정기를 함께 사용하는 관리법은 표준 관리법에 비해 혈당 감소에 더욱 효과적임이 밝혀졌다. 실제 임상진료에 활용가능성이 높다는 평가를 받아 당뇨병 분야 최고 권위지인 Diabetes Care에 발표되었다.
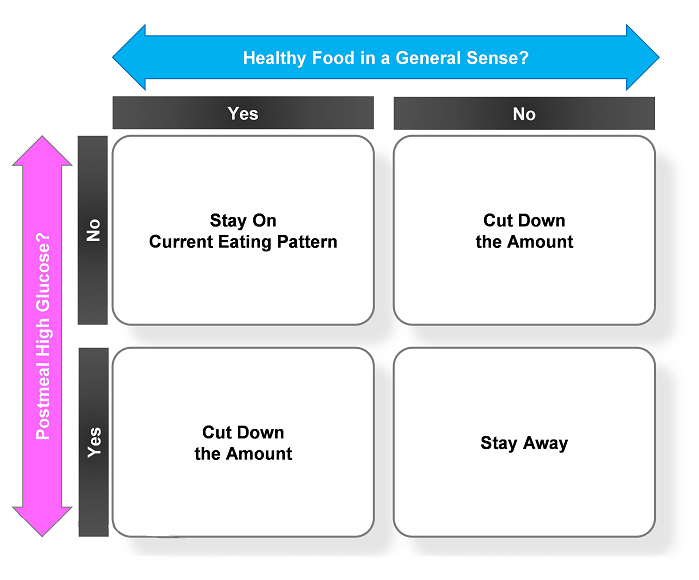
< SEOUL 알고리즘 구조 >
Derivation of prognostic contextual histopathological features from whole-slide images of tumours via graph deep learning
Nature Biomedical Engineering. 2022




좌부터 문경철 교수(병리학교실, 교신저자), 권성훈 교수(전기정보공학부, 교신저자),
박정환 교수(보라매병원 병리과, 제1저자), 오소희 교수(보라매병원 의생명연구소, 제1저자)
이번 연구는 서울의대 병리학교실 연구팀과 서울대 전기정보공학부 권성훈 교수 연구팀과 공동으로 수행한 연구로, 고해상도 디지털 슬라이드 이미지에서 암조직 내 종양세포와 주변 미세환경간의 상호작용을 새로운 그래프 딥러닝 방법으로 분석하여 보다 정교하게 예후를 예측하고 병리학적으로 해석 가능한 예후인자들을 탐색한 연구이다.
최근의 공학적 발전은 전통적인 병리학에 여러 변화를 가져왔다. 대표적으로 고해상도 디지털 슬라이드 스캔으로 생산되는 고해상도 whole slide image(WSI)는 전통적인 광학현미경 관찰을 모니터 판독으로 대체해가고 있고, 딥러닝의 발전으로 인해 병리 영상분석 역시 급격히 발전하여 임상적 활용을 모색하고 있다. 딥러닝 기반 병리학은 주로 convolutional neural network(CNN)를 적용하였으나 여기에는 여러 한계가 있고 특히 CNN의 경우 종양세포 자체 혹은 작은 영역의 국소적 특성들에 초점을 맞추게 된다. 하지만 실제 병리의사들은 국소적인 병리학적 특성을 주변의 다른 특성들의 맥락 속에서 바라보게 되며, 주변 환경과의 관계를 고려하여 판단하게 된다. 그러므로 딥러닝을 이용한 병리 영상분석에서도 국소적인 병리학적 특성들 사이의 상호 관계를 고려하여 국소적 특성과 주변 환경을 동시에 반영하는 유의미한 상황적 특성들을 추출해낼 수 있는 모델이 필요하다.
이런 목적을 달성하기 위해 graph neural network(GNN)를 사용할 수 있는데 이를 바로 WSI에 적용하는 데는 몇 가지 제한점이 있다. 이번 연구에서는 이러한 제한점들을 해결한 새로운 tumor-environemnt-associated context learning using graph deep learning (TEA-graph) 모델을 고안하였는데, 이 모델을 투명세포신세포암에 적용시켰을 때 특정 조직병리학적 특성들을 주변의 다른 특성들의 분포를 고려하여 분석할 수 있었고, 병리학적으로 해석 가능한 조직학적 예후지표를 찾아내었으며, 이러한 지표가 통상의 조직학적 예후인자보다 더 명확히 예후를 계층화함을 보여주었다.
이번 연구는 공학과 의학의 모범적인 협업연구로, 새로운 모델을 개발하기 위해 의학에서 정교하게 가공된 샘플과 정보를 제공하고 공학팀과 끊임없이 상호작용함으로써 기존의 유사연구보다 진일보한 모델을 개발하고 실증하였으며, 임상적 이용 가능성을 제시하는 우수한 연구결과를 얻을 수 있었다.
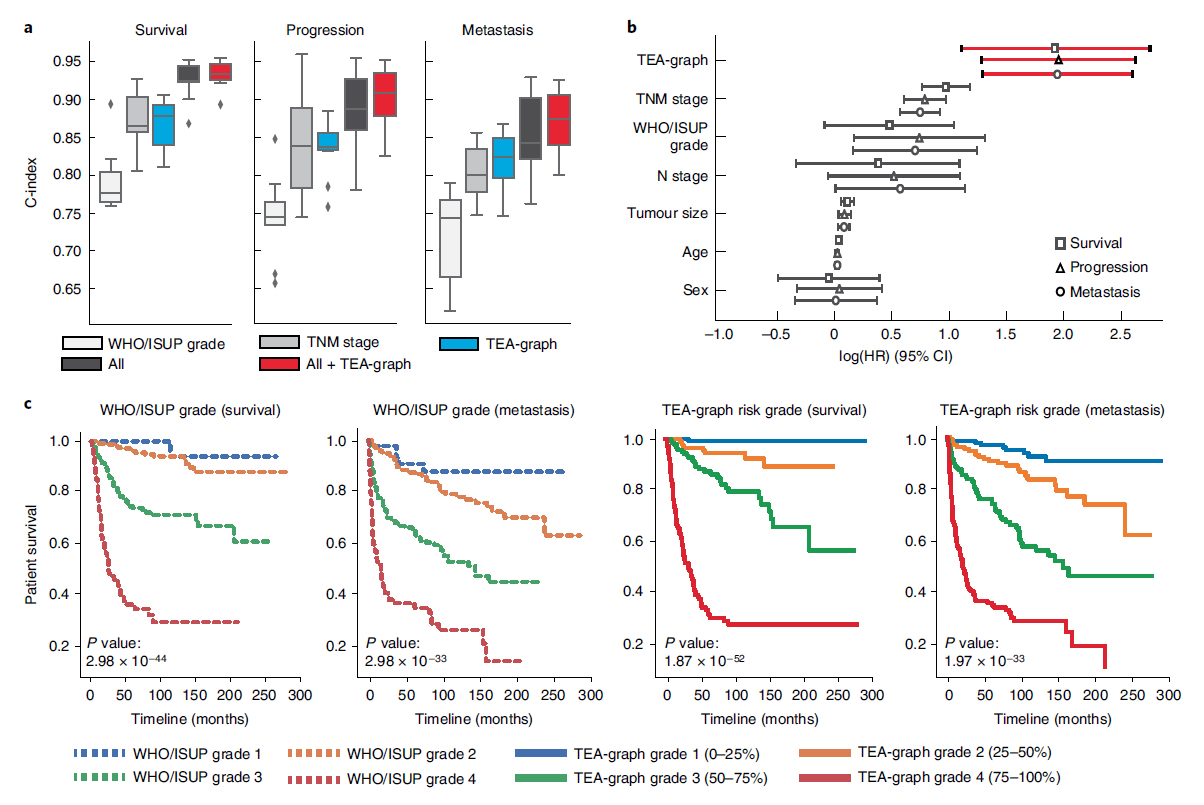
< 기존의 전통적 예후인자와 비교한 TEA-graph의 예후 예측 성능 >
Transcriptional signatures of the BCL2 family for individualized acute myeloid leukaemia treatment
Genome Medicine, 2022



좌부터 윤성수 교수(내과학교실, 교신저자), 고영일 교수(서울대학교병원 혈액종양내과, 교신저자), 윤홍석 교수(서울대학교병원 임상유전체의학과, 교신저자)
급성 골수성 백혈병(Acute Myeloid Leukemia, AML)은 성인의 급성 백혈병 중 가장 흔한 형태로서 약 65%를 차지하며, 생물학적 특징에 따라 치료 반응 및 예후가 달라진다. 급성 골수성 백혈병 치료에 있어 FDA 승인을 받아 널리 사용되고 있는 약제로 venetoclax가 있다. 하지만 최근 임상 연구(Blood. 2019 Jan 3; 133(1): 7–17)에 따르면, Overall response rate는 약 68%로 venetoclax 치료 효과는 제한적이다.
Venetoclax는 암세포의 세포사멸(apoptosis)을 억제하는 BCL2 단백질을 저해하는 작용을 한다. 하지만 일부 환자군에서는 BCL2 단백질과 유사 기능을 가지는 다른 BCL2 family 단백질(MCL1 혹은 BFL1 등)이 활성화되어 있다. 이는 venetoclax의 치료 효과 감소로 이어지며, 이를 극복하기 위한 연구가 활발히 이루어지고 있다.
본 연구에서는 비음수 행렬 분해(Non-negative matrix factorization, NMF)를 활용해 BCL2 family의 조절에 관여하는 유전자들을 선별하는 알고리즘을 개발하였으며, 해당 유전자의 전사체 데이터(whole transcriptome sequencing)를 사용해 BCL2 family signature (BFSig)라는 새로운 biomarker를 고안하였다. BFSig를 활용하여 Venetoclax의 치료 효과를 높은 정확도로 예측할 수 있음을 증명하였다(AUC=0.874, 그림 1). 또한, 실제 임상 현장에서 유전자 발현 분석을 위해 사용되는 나노스트링 기술을 활용해 BFSig의 임상 적용 가능성을 검증하였다. 추가로, BFSig의 패턴에 따라 AML 환자가 3가지 아형으로 분류됨을 밝혔으며, 아형별로 BCL2, MCL1 그리고 BFL1 중 어떤 단백질을 치료제의 표적으로 할지 판별할 수 있음을 제시한다(그림 2).
본 연구의 결과를 활용하면, 향후 급성 골수성 백혈병 치료에 있어 BCL2 계열의 유전자 활용 전략을 쉽고 효과적으로 수립해 환자에게 최적화된 정밀 의료를 실현할 수 있을 것으로 기대한다.
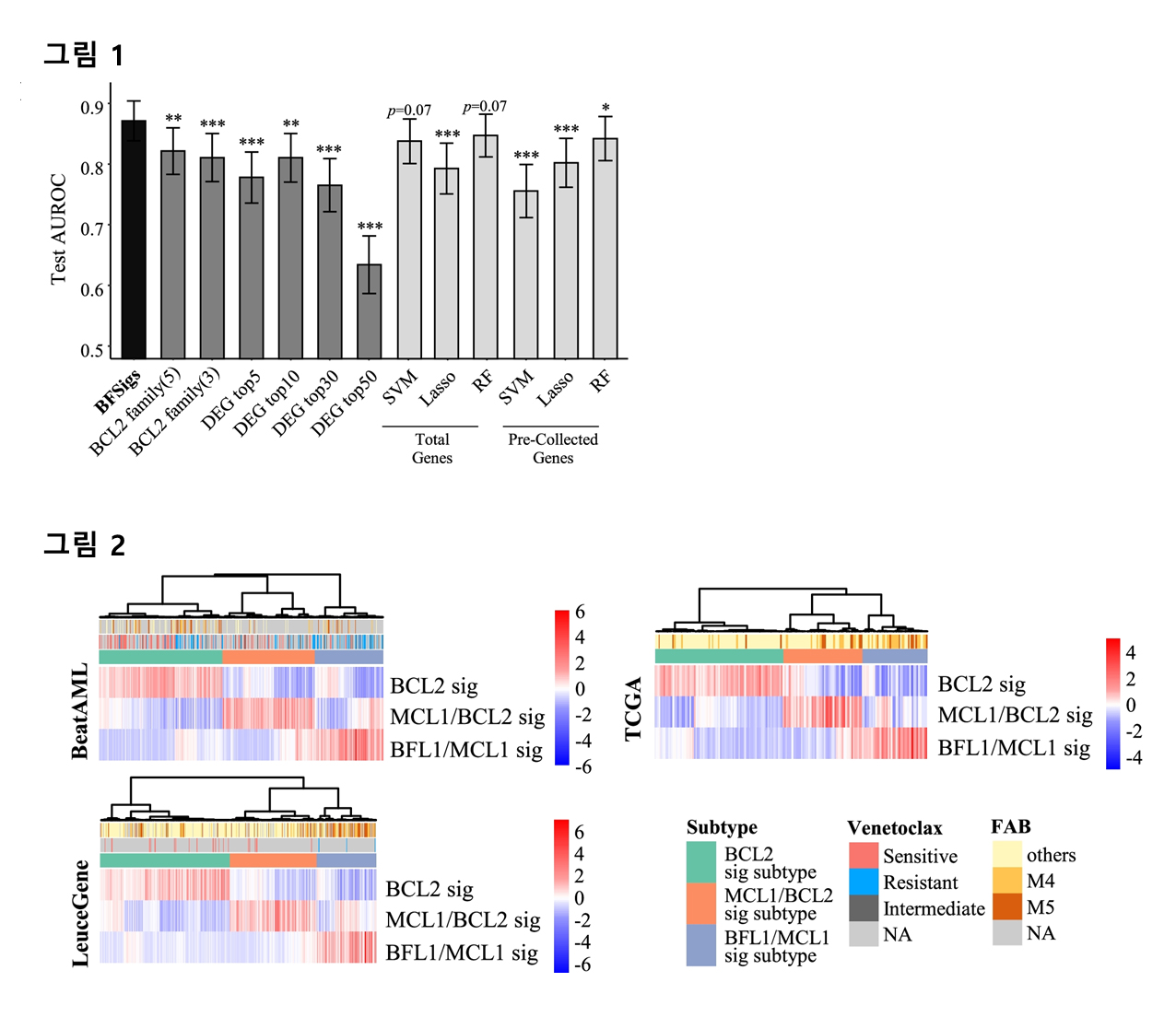
<그림1. 급성 골수성 백혈병에서 BFSig의 venetoclax 반응성 예측 성능>
<그림2. 급성 골수성 백혈병의 BFSig 기반 3가지 아형>
논문링크 : https://genomemedicine.biomedcentral.com/articles/10.1186/s13073-022-01115-w

