[연구동향]
Interventions for Glaucoma Medication Adherence Improvement: A Network Meta-analysis of Randomized Controlled Trials
Ophthalmology, 2022

김영국 교수
(안과학교실, 교신저자)
질환의 성공적인 치료를 위해서는 의사의 처방과 지시를 잘 따르는 이른바 ‘환자 순응도’가 무엇보다 중요하다. 하지만 만성질환의 경우 당장 생활에 큰 불편이 없는 경우가 많아 순응도가 상대적으로 낮다. 황반변성, 당뇨망막병증과 함께 세계 3대 실명질환으로 알려진 녹내장 역시 환자 순응도가 낮은 질환 중 하나다. 녹내장 환자의 낮은 약물 순응도가 실명에까지 영향을 미친다는 사실이 잘 알려져 있지만, 전체 녹내장 환자의 반 수 이상이 약을 제대로 사용하고 있지 않을 정도로 순응도가 좋지 못한 것으로 알려져 있다.
약물 순응도 연구는 크게 3가지 주제로 분류된다 ([1] 순응도 Monitoring, [2] 순응도 예측, 그리고 [3] 순응도 향상 Intervention). 이 중에 [3] 관련하여 다양한 Interventions이 고안되어 왔고, 개발된 Intervention의 효과를 검증하기 위한 무작위 배정 임상시험(Randomized Controlled Trials, RCT) 결과들도 발표되어 있다. 2021년 11월 기준으로 총 4,981명의 환자를 대상으로 한 19개의 RCTs가 확인되었으며, 여기에는 11종류의 Interventions이 포함되어 있었다. 그러나 이 연구 결과들만으로는 어떤 Intervention이 가장 효과적인지 확인할 수 없고, 실제 임상 진료에 적용되기 위해서는 Data Transformation and Integration 과정이 필요하다. 즉, Head-to-Head Comparison 형식의 RCTs를 Network Meta-Analysis(NMA)를 이용해 끊김 없이 하나로 연결함으로써 11개 Interventions의 효과 순위를 확인하는 과정이 선행되어야 한다.
본 논문은 11종류의 Interventions(Standard of Care/ Short Message Service/ Telephone Call/ Device Reminder; Motivational Interview/ Multimedia Education/ Physician Education/ Provision of Own Medical Records/ Incentives/ Tailored Care/ Enhanced Standard of Care) 중에 Tailored Care(환자 개인별로 순응도에 어려움이 되는 요인이 무엇인지를 확인하고 이에 맞추어 순응도를 향상시킬 수 있는 개인 맞춤형 Care Plan을 설정하는 방법)가 녹내장 약물 순응도 향상에 가장 효과적임을 확인했다.
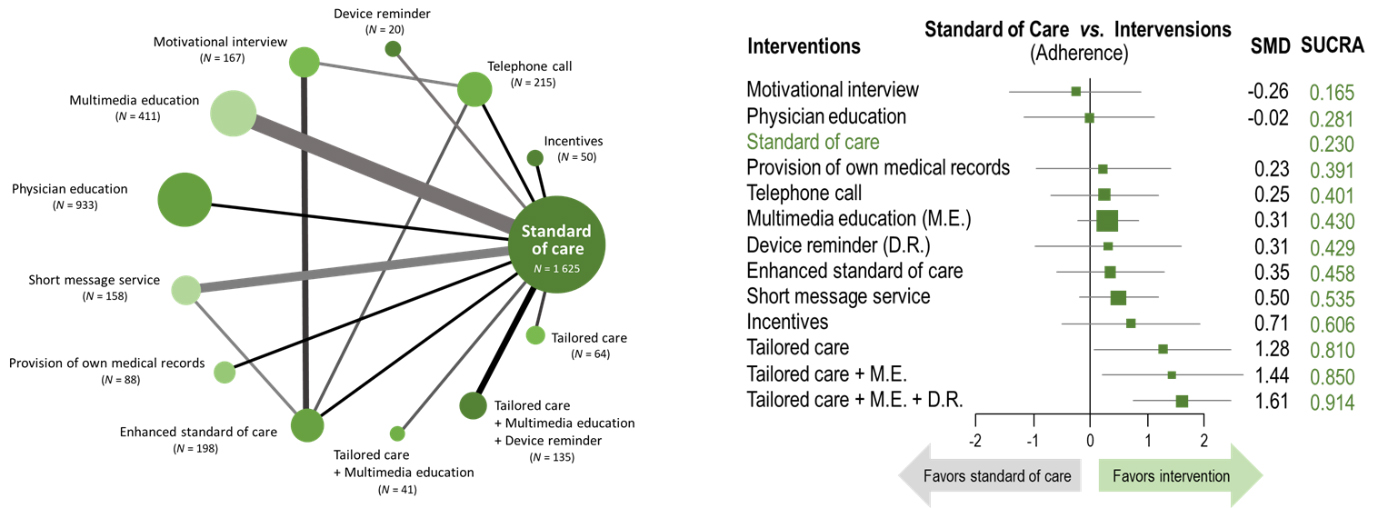
<Network map(좌) 과 forest plot(우)>
Inducing Ectopic T Cell Clusters Using Stromal Vascular Fraction Spheroid-Based Immunotherapy to Enhance Anti-Tumor Immunity
Advanced Science, 2022

조남혁 교수
(미생물학교실/의과학과,
공동교신저자)

장나윤 학생
(의과학과,
공동제1저자)
수지상세포는 강력한 항원 제시 세포로서, 외부 항원을 획득하여 림프절의 naive T 세포에게 항원을 전달하여 적응면역반응을 시작할 수 있도록 한다. 수지상세포의 이런 능력 덕분에 수지상세포 항암면역치료제가 개발되었지만 기대했던 것보다 임상시험은 부진하다.
본 연구에서는 수지상세포 매개 면역 반응을 향상시키기 위해 지방 조직에서 추출한 기질세포를 수지상세포의 활성을 높일 수 있는 구조적 프레임으로 활용하였다. 지방 조직 유래 기질세포를 얻기 위하여, 내장 및 피하 지방으로부터 기질혈관 분획을 분리 및 배양 후 3차 구조 스페로이드 형태로 배양하여 사용하였고, 마우스 골수로부터 수지상세포를 분화 배양하여 사용하였다.
배양된 기질혈관분획은 표현 형질과 기능이 림프절 기질세포와 유사한 세포들로 구성되어 있음을 확인하였다. 기질혈관분획 스페로이드는 혈관과 유사한 구조를 생체 내외에서 형성하였으며 면역세포를 불러오는 케모카인들을 발현하여 대조군보다 훨씬 많은 숫자의 T 세포가 불러오는 것을 확인하였다. 또한 기질혈관분획은 함께 배양한 수지상세포의 활성화 정도와 분열능력, 생존능이 증가했음을 확인하였다. 기질혈관분획 스페로이드와 항원을 탑재한 수지상세포를 면역한 마우스에서 대조군 대비 항원 특이적 T 세포 면역반응이 유의미하게 향상되어 있음이 관찰되었으며, 종양에 대한 항암 효과 또한 유의하게 향상되어 있음을 알 수 있었다.
종합해 볼 때, 배양한 기질혈관분획은 림프절 기질세포와 유사한 세포를 만드는 데 사용될 수 있고, 수지상세포 면역치료의 항원 특이적 면역 반응을 증가시키기에 본 연구는 지방 조직에서 분리한 기질혈관분획을 활용하여 수지상세포 매개의 면역 반응을 향상시킬 수 있는 새로운 방법을 제시하였다.
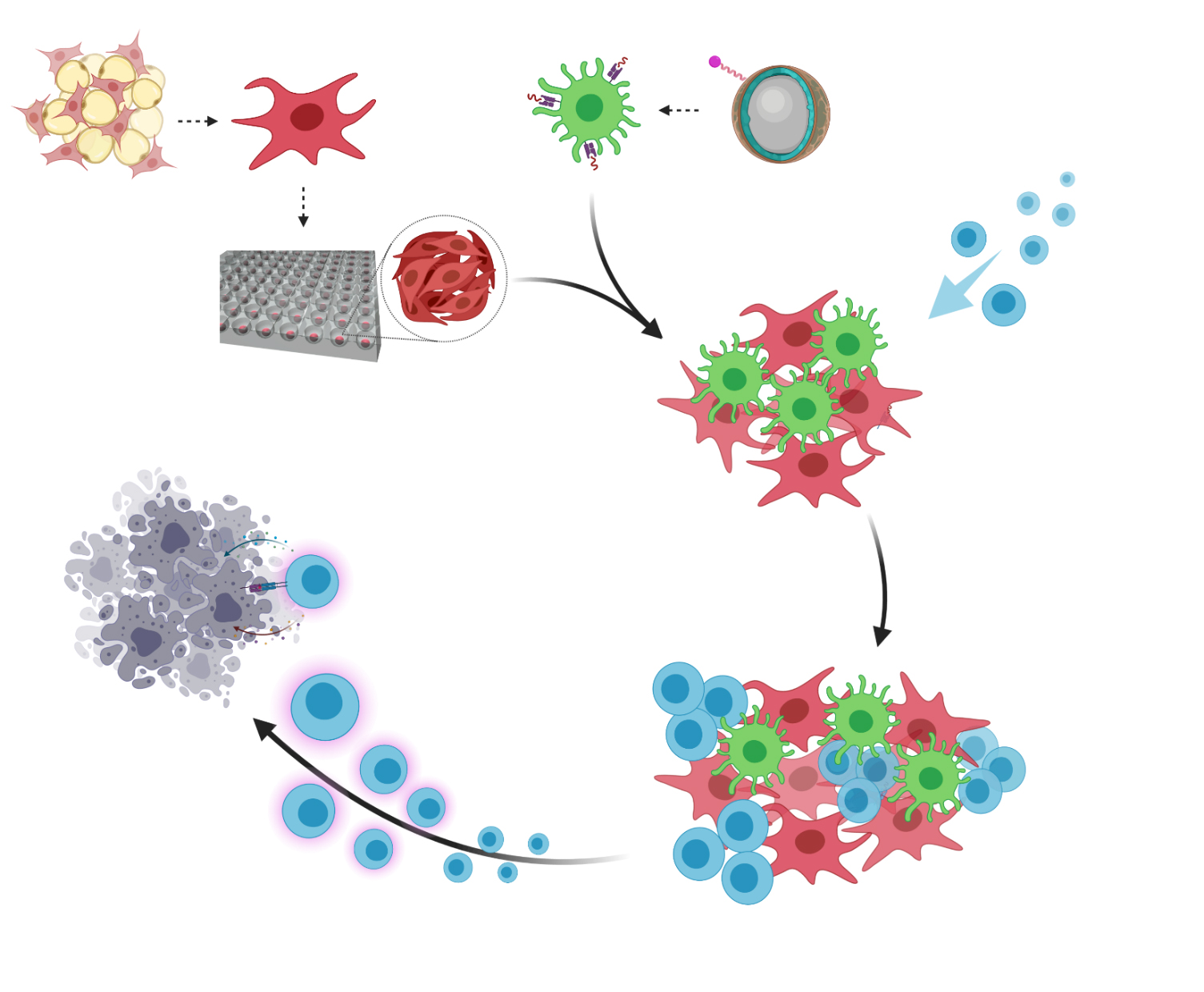
< Schematic strategy for generation of in situ ectopic lymphoid clusters to enhance anti-tumor effect. Cellular engineering of stromal vascular fraction (SVF) cells and dendritic cells (DCs), through three-dimensional spheroid culture and nanoparticles for antigen delivery, improves immune response via generation of in situ artificial tertiary lymphoid structures.>
논문링크 : https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202203842
PD-L1-directed PIGF/VEGF blockade synergizes with chemotherapy by targeting CD141+ cancer-associated fibroblasts in pancreatic cancer
Nature Communications, 2022

정기훈 교수
(해부학교실/의과학과,
교신저자)

김덕기 박사
(의과학과,
공동제1저자)

정주희 학생
(의과학과,
공동제1저자)
췌장암은 각종 소화 효소와 인슐린을 분비하는 췌장에 발생한 종양으로 초기 증상이 잘 나타나지 않아 조기 발견율이 매우 낮고, 진단 당시 50%의 환자가 진행된 병기(Advanced stage)에 위치하고 있다. 또한 5년 생존율이 약 10% 정도밖에 되지 않는 매우 예후가 좋지 않은 암종이다. 애플 창업자인 Steve Jobs도 극복하지 못한 이 췌장암의 경우, 치료적 한계가 명확한 세포독성 화학항암제가 아직도 주치료법으로 사용되고 있으며, 표적항암제(Targeted therapy)나 최근 다양한 암종에서 주목할 만한 효과를 보이고 있는 면역관문억제제(Immune-checkpoint inhibitor)의 경우 췌장암 치료에는 큰 효과를 보이지 못하고 있다.
췌장암 치료저항성의 대표적인 원인으로 암세포 주변에 콜라젠과 같은 세포외기질이 과도하게 침착되어 결합조직이 형성되는 종양 섬유화(Tumor desmoplasia)를 꼽을 수 있다. 종양 섬유화는 치료약물의 전달을 방해할 뿐만 아니라, 혈관 압박(Vessel compression) 및 저산소증을 유발하여 종양세포 악성화 증가, 면역억제성 세포로의 형질 전환, T 세포 억제 등 다양한 치료저항성 기전을 활성화한다. 암세포 주위에 존재하는 암-연관 섬유아세포(Cancer-associated fibroblast)가 콜라젠으로 대표되는 세포외기질을 분비하여 종양 섬유화를 주로 유도하기 때문에, 국내외 제약회사들이 앞다투어 암-연관 섬유아세포를 타겟하여 종양 섬유화를 조절하는 치료제 개발에 뛰어들고 있다.
연구진은 췌장암에서 가장 많이 사용되고 있는 기존 항암제 중 하나인 Gemcitabine이 오히려 종양 내 PlGF/VEGF-A를 증가시키고, 이로 인해 췌장암 주변 암-연관 섬유아세포가 활성화되고 종양 섬유화가 촉진되는 것을 발견하였다. 이를 효과적으로 억제하기 위하여 연구진은 종양 내 PlGF/VEGF-A와 PD-L1을 동시 타겟하는 항암제 후보물질 Ate-Grab을 개발하였으며, 전임상 마우스 췌장암 모델에서 항종양 효과를 확인하고 Two-photon microscope(이광자 현미경)을 통해 항섬유화 효과를 검증하였다. 뿐만 아니라, Single-cell RNA 시퀀싱을 통해 Gemcitabine과 Ate-Grab의 병용 요법이 기존에 보고된 바 없던 CD141 양성의 암-연관 섬유아세포를 특이적으로 감소시킴을 발견하였다. 흥미롭게도 CD141 양성 암-연관 섬유아세포는 병적인 섬유화를 촉진 및 안정화하는 여러 가지 유전자적 특성을 지니고 있었으며, 특히 나쁜 예후의 췌장암 환자들에서 높은 연관성을 나타내었다. 이를 통해 기존 치료제인 Gemcitabine과 신약 후보물질 Ate-Grab 병용 요법의 높은 임상적용 가능성을 확인할 수 있었다.
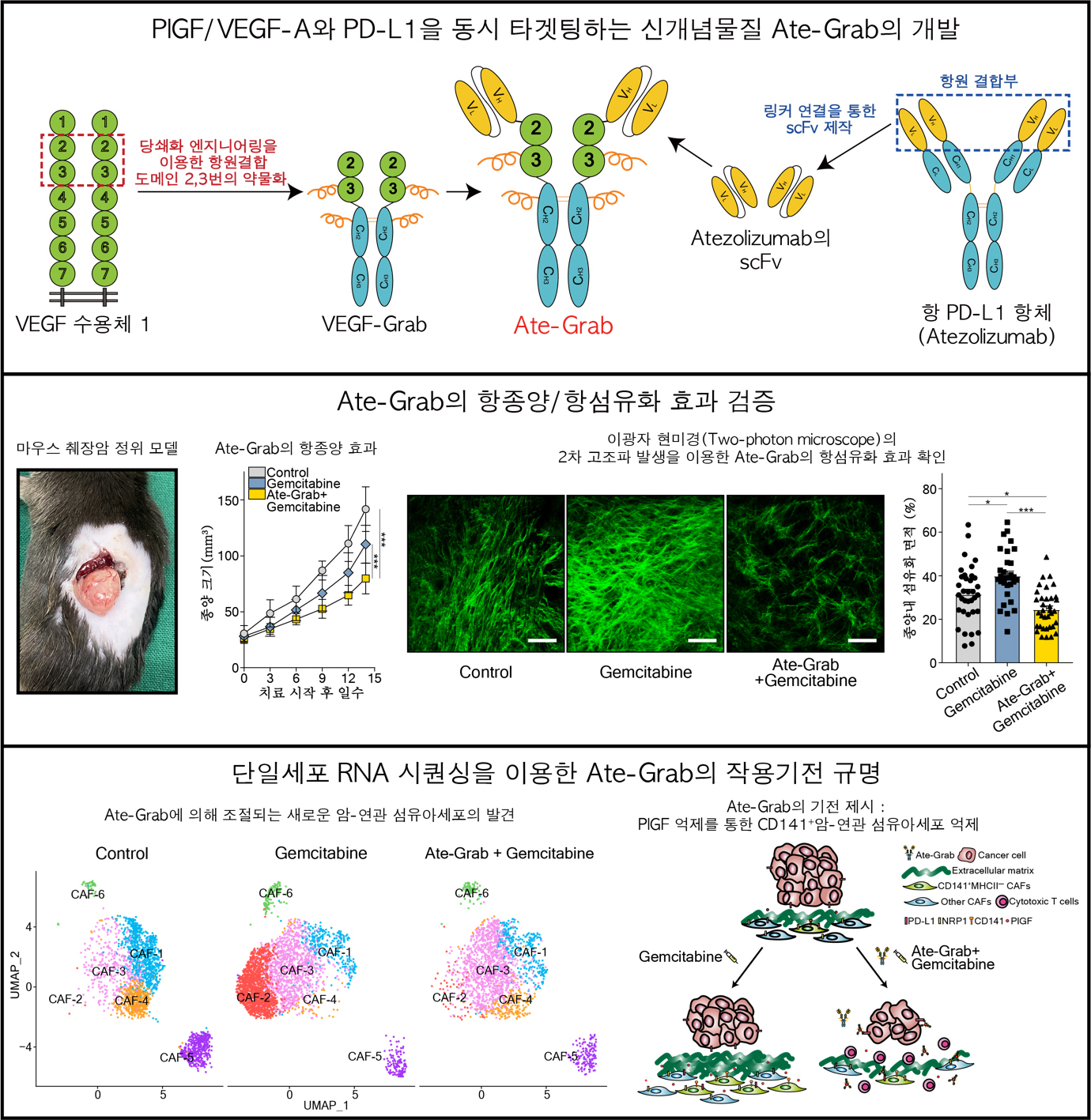
<논문 핵심 내용 모식도>
1) PlGF/VEGF-A와 PD-L1을 동시 타겟팅하는 신개념물질 Ate-Grab의 개발
단백질 공학(Protein engineering)을 활용한 PLGF/VEGF-A와 PD-L1을 모두 표적할 수 있는 새로운 다중 파라토픽 디코이 수용체(Multi-paratopic decoy receptor)를 제작함.
2) Ate-Grab의 항종양/항섬유화 효과 검증
마우스 췌장암 정위 모델을 활용하여 Ate-Grab의 생체 내(in vivo) 효과를 분석함. 병합요법시 Gemcitabine 단독 투여에서 증가되는 종양 섬유화를 효과적으로 개선시키며 항종양 효과의 뚜렷한 상승을 가져옴.
3) 단일세포 RNA 시퀀싱을 이용한 Ate-Grab의 작용기전 규명
단일세포 RNA 시퀀싱을 이용한 종양내부 미세환경에 대한 심층적 이해를 통해 Ate-Grab의 작용기전을 규명하고 새로운 타겟이 되는 CD141 양성 암-연관 섬유아세포 아형을 발견함.
The Cys-N-degron pathway modulates pexophagy through the N-terminal oxidation and arginylation of ACAD10
Autophagy, 2022

권용태 교수
(의과학과,
교신저자)

권순철 학생
(의과학과,
공동제1저자)
Arg/N-degron 경로는 N-말단에 어떠한 아미노산이 노출되는지에 따라서 단백질의 반감기가 결정된다는 N-end rule의 한 분류로, N-말단에 존재하는 아르기닌 (arginine) 혹은 N-말단 변형 (N-terminal modification)에 의해 아르기닌화된 단백질이 일련의 과정을 통해서 분해되는 것을 말한다. N-말단에 노출된 시스테인 (cysteine)은 산화되어 시스테인술폰산(Cysteine sulfinic acid) 또는 시스테인설폰산(Cysteine sulfonic acid)을 형성하고 R-transferase인 ATE1에 의해서 아르기닌화(arginylation) 되어 새로운 분해 신호로 작용한다. 시스테인이 산화가 되는 특성 때문에 N-말단에 노출된 시스테인은 산소와 산화적스트레스를 감지하는 센서로서 작용한다. 산화스트레스를 유발하는 활성산소는 세포내에서 퍼록시좀, 마이토콘드리아에서 많은 양이 생성된다. 과도하게 생성된 활성산소에 의해 세포소기관은 쉽게 손상되며, 손상된 세포소기관은 새롭게 대체되기 위해서 오토파지를 통해서 분해된다. 하지만, 어떻게 세포소기관이 산화스트레스를 감지하고 분해가 되는지에 대해서 아직 많은 부분이 규명되지 않았다.
권용태 교수 연구진은 세포소기관에 위치한 N-말단에 시스테인을 갖는 단백질이 활성산소를 감지하여 오토파지로의 분해를 유도할 것이라고 생각하였다. 이에 따라 시스테인설폰산으로 산화되고 아르기닌화 된 N-말단 시스테인을 검출할 수 있는 항체를 제작하였고 면역형광법을 사용하여 퍼록시좀에 변형된 시스테인이 높은 수준으로 위치하는 것을 확인하였다. 이 산화되고 아르기닌화된 단백질이 무엇인지 규명하기 위해서 N-말단에 시스테인을 갖는 단백질들을 스크리닝 하였고 ACAD10 (Acyl-CoA dehydrogenase family, member 10)이 아르기닌화와 오토파지 수용체인 p62/SQSTM1을 통해 퍼록시좀의 분해를 매개한다는 것을 규명하였다. 그리고 실제로 proteinase K protection assay, Carbonate extraction assay를 통해서 ACAD10이 퍼록시좀의 막 표면에 존재한다는 것을 확인하였다. 마지막으로 ATE1 억제제인 tannic acid를 통해 Arg/N-degron 경로를 조절함으로써 퍼록시좀의 분해를 막을 수 있는 것을 확인하여, 과도한 펙소파지에 의해서 발생하는 치명적인 질병인 젤웨거 증후근의 치료 가능성을 제시하였다.
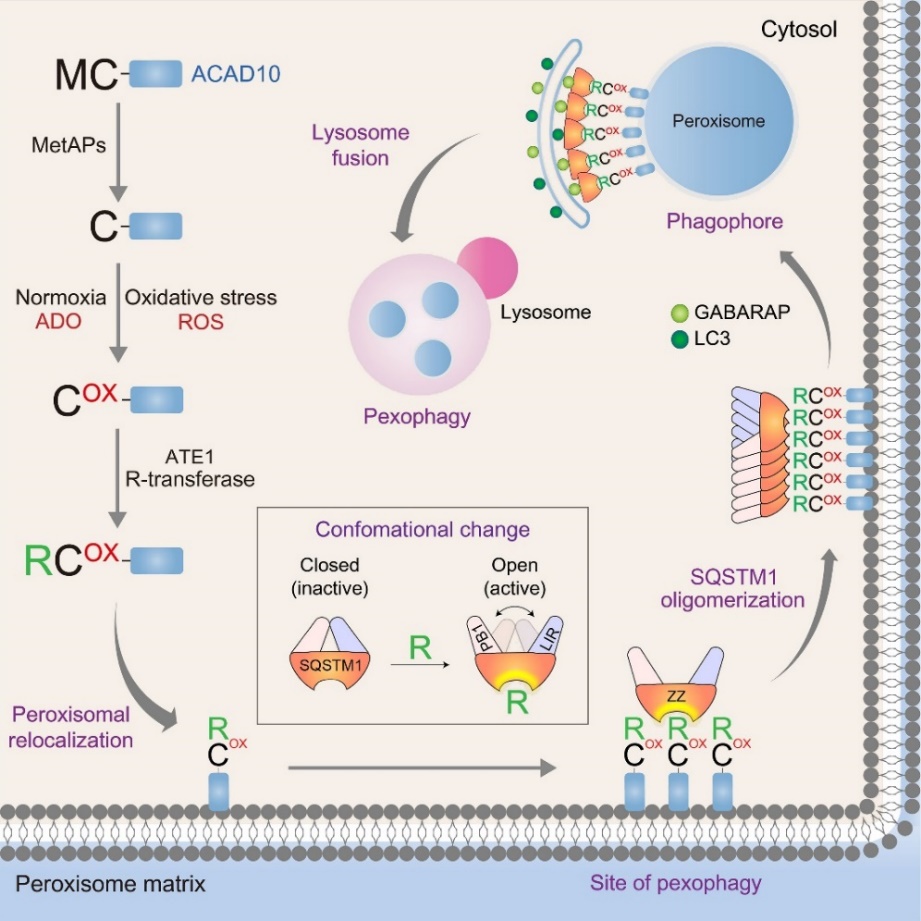
<ACAD10의 N-말단 시스테인의 산화와 아르기닌화를 통한 펙소파지 조절>
논문링크 : https://www.tandfonline.com/doi/full/10.1080/15548627.2022.2126617
9 months of delamanid, linezolid, levofloxacin, and pyrazinamide versus conventional therapy for treatment of fluoroquinolone-sensitive multidrug-resistant tuberculosis (MDR-END)
Lancet, 2022

임재준 교수
(내과학교실, 교신저자)
가장 강력한 결핵약제인 Isoniazid와 Rifampicin에 동시에 내성을 가진 ‘다제내성결핵’은 20개월 이상 치료해도 치료 성적이 좋지 않고 부작용이 심해 인류보건에 큰 부담이 되어왔다. 특히 치료 초기 8개월간 사용해야 하는 Aminoglycoside 계통의 주사약제는 주사 부위 통증은 물론 비가역적인 청력 손상이나 신기능 저하를 일으킬 수 있어 큰 문제였다. 최근 몇 가지 새로운 결핵 약제들이 개발되었는데, 이를 이용하여 다제내성결핵의 치료 성적을 향상시키고 치료 기간을 단축시킬 수 있을지 여부가 초미의 관심사가 되었다.
임재준 교수는 대한결핵 및 호흡기학회 결핵연구회, 국제결핵연구소, 서울대병원 의학연구협력센터, 결핵연구원으로 구성된 연구팀을 이끌고 신약을 포함하여 경구약제로만 구성된 9개월 단기 치료법을 고안하여 무작위배정 임상시험을 통해 효과를 확인하였다. 연구 디자인과 통계분석은 의학과 한서경 교수가 주도하였으며, 연구비는 질병관리청에서 지원하였다.
연구팀은 12개 기관에서 진단받은 19-85세 사이의 Flouroquinolone 감수성 다제내성/리팜핀내성 결핵환자들이 참여하는 다기관, 무작위배정, 공개, 2/3기 비열등성 임상시험을 진행하였다. 단기치료군(시험군)은 Delamanid, Linezolid, Levofloxacin, Pyrazinamide 를 9개월 동안 복용했고, 대조군은 당시 WHO 지침에 따라 초기 8개월의 주사제를 포함한 약제들로 20-24개월 동안 치료받았다. 임상 시험의 1차 종료점은 치료 시작 후 24개월 시점의 치료성공률이었고, 비열등성 기준은 -10%였다. Modified intention-to-treat analysis 를 주분석으로 삼았고, Per-protocol 분석도 함께 시행하였다.
2016년 3월 4일부터 2019년 9월 14일 사이에 모두 214명의 환자가 연구에 참여하였고, 그 중 168명이 최종 분석에 포함되었다. 치료 시작 후 24개월째 치료성공률은 단기치료군에서 75.0%로 대조군의 70.6% 보다 높았으며, 비열등성 기준을 만족하였다. (4.4% 차이, 97.5% 단측 신뢰구간 - 9.5% to ∞) 단기치료군과 대조군 사이에 부작용은 차이가 없었다. 이로서 임재준 교수팀은 부작용이 심한 주사약제 없이 경구약제로만 구성되었으며 치료 기간은 기존의 반 이하인 9개월에 불과한 새로운 다제내성결핵 치료 방법을 확립하였다. 미국 하버드 의과대학의 Jennifer Furin 교수는 함께 출판된 사설에서 ‘경구약제로만 구성된 단기치료요법의 효과에 대한 최고 수준의 근거를 제시한 기념비적 연구’라고 치하했다.
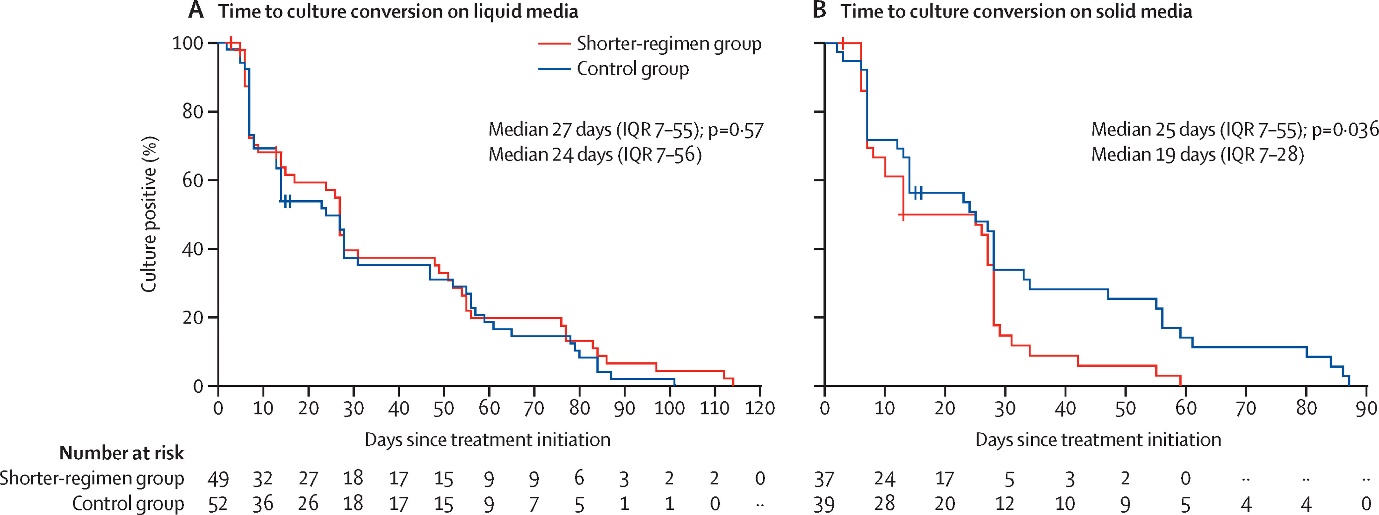
<고체배지에서 결핵균 배양 음전까지 소요되는 시간은 단기치료법을 사용한 경우 중앙값 19일로 기존의 통상치료를 받은 환자들에서의 기간(중앙값 25일)보다 더 짧았다. (P=0.036)>
논문링크 : https://www.sciencedirect.com/science/article/pii/S0140673622018839

