[연구동향]
Sodium Cholate-Based Active Delipidation for Rapid and Efficient Clearing and Immunostaining of Deep Biological Samples
Small Methods, 2021

장성호 교수
(생리학교실/의과학과)

나명수 박사과정
(생리학교실/의과학과)
실제 사람의 조직은 불투명하기 때문에 그 속에 있는 세포들의 구조와 형태를 있는 그대로 관측하기란 불가능하다. 하지만 빛의 투과를 방해하는 지질을 조직에서 제거하게 된다면 조직이 투명하게 되고, 그 속에 숨어있었던 세포들이 3차원으로 드러나게 된다. 이러한 ‘조직 투명화’ 기술은 뇌를 포함한 다양한 장기들의 구조적 연구나 진단검사를 가능케 해주는 획기적인 기술로서 각광받고 있으나 처리 시간이 오래 걸리고, 조직 손상에 대한 위험성으로 인해 한계에 부딪히게 되었다.
서울대학교 의과대학 생리학교실 장성호 교수 연구팀은 기존 투명화 기술에서 오랫동안 사용되어 왔던 계면활성제인 SDS (Sodium dodecyl sulfate) 대신 작은 마이셀을 형성하는 SC (Sodium cholate)가 조직 투과에 더 용이하며 투명화에 적합하다는 사실을 확인하였다. 또한 SC를 사용하면서 생기는 기술적인 문제를 이온 전도성막을 이용해 해결하였다. SCARF라고 명명한 이 투명화 기술은 쥐 뇌 절편과 태아를 10분만에 완벽하게 투명화 시킬 수 있었고, 이는 기존방법보다 약 200배 빠른 속도이다. 또한 개발된 초고속 투명화 기술은 조직의 손상도 없는 것으로 확인되었다. SCARF 투명화 기술을 통해 3차원 조직 진단의 상용화를 앞당길 수 있으며, 뇌 구조적 연결성을 시각화한 ‘뇌 지도’ 제작에도 큰 도움이 될 것이라 기대된다. 본 연구결과는 Nanoscience & Nanotechnology 분야 최상위 국제 학술지 중 하나인 Small Methods (IF 14.188) 에 11월 5일자로 게재되었다.
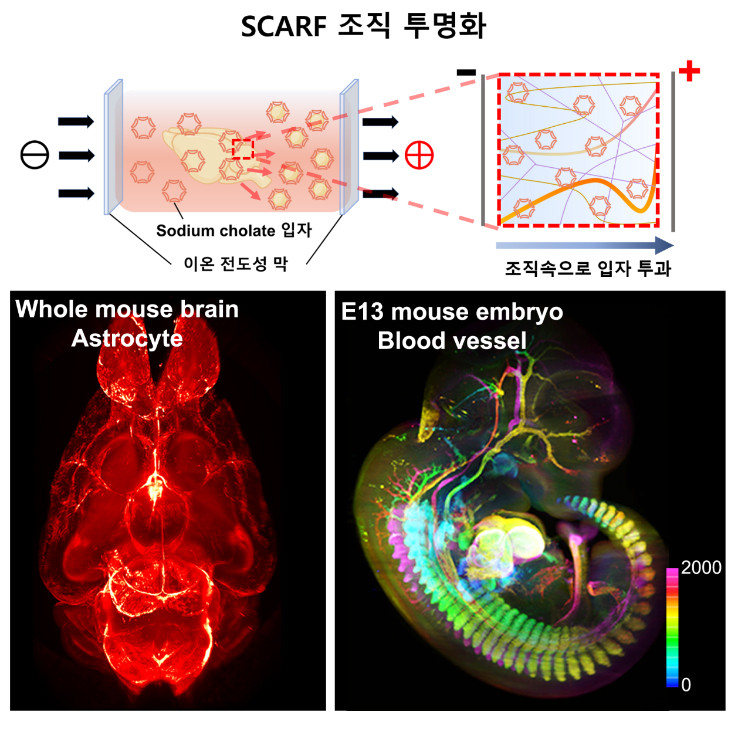
<그림. 초고속 조직 투명화 기술 (SCARF) 개요도. Whole mouse brain과 E13 mouse embryo를 SCARF를 이용해 초고속으로 (Embryo: 10분, Whole brain: 18시간) 조직 손상 없이 투명화 시킴. 이후 항체를 이용해 특정 단백질을 표지 후 3차원 이미징을 진행>
논문링크 : https://onlinelibrary.wiley.com/doi/10.1002/smtd.202100943
A unique population of neutrophils generated by air pollutant-induced lung damage exacerbates airway inflammation
J Allergy Clinical Immunol, 2021

김혜영 교수
(의과학과)

신재우 박사과정
(의과학과)
대기오염은 인류의 건강을 크게 위협하고 있는 위험 요인으로 대기오염에 장시간 노출되었을 때, 뇌졸증, 심장마비, 당뇨병, 암과 같은 만성질환의 악화로 인한 조기사망률이 증가할 수 있다. 호흡기계는 대기오염물질에 직접적으로 노출되는 장기이며, 대기오염은 만성 호흡기질환인 천식 및 만성 폐쇄성 폐질환의 주요 악화요인으로 작용한다. 그럼에도 불구하고 현재까지 어떠한 면역반응을 통해 만성 호흡기 질환이 악화될 수 있는지 명확하게 규명되지 않았다.
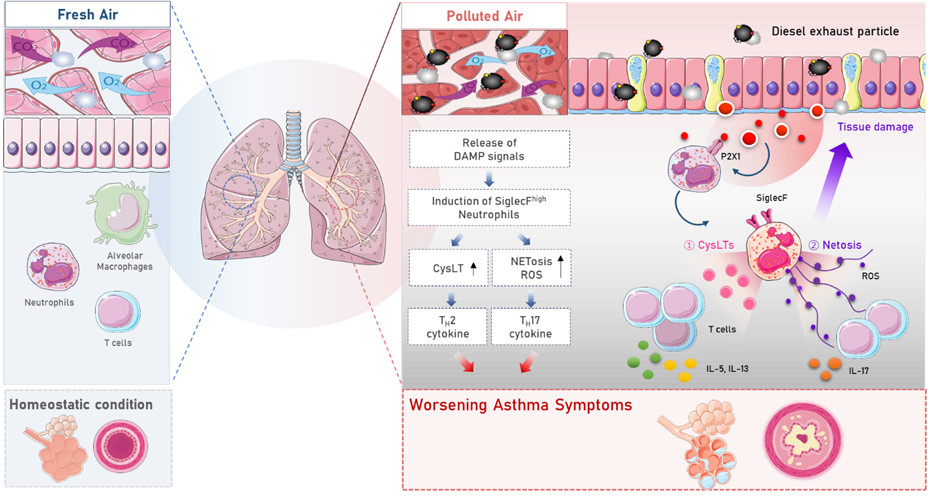
본 연구에서는 초미세먼지의 주요 원인인 디젤연소 미세먼지(Diesel exhaust particulate, DEP)가 마우스의 폐에서 기존에 알려지지 않았던 새로운 유형의 호중구를 발생시킨다는 것을 확인하였다. 이 호중구는 대기오염 노출로 인해 손상된 폐조직에서 분비되는 손상연관분자패턴(DAMP)에 의해 생성될 수 있으며, 다량의 cysteinyl leukotriene (CysLT) 및 호중구세포외그물(Neutrophil extracellular trap, NET)을 생성함으로써 천식 및 만성폐쇄성 폐질환의 주요 특징인 기도저항성, 기도염증, 및 폐기종의 악화를 유발하였다 (그림). 중증 천식환자의 객담 및 혈액에서도 마우스 연구에서 발견한 새로운 호중구의 특징을 가지고 있는 세포가 증가되어 있는 것을 확인하였다. 따라서 본 연구에서 규명한 새로운 호중구 세포가 대기오염으로 인한 난치성 만성 폐질환을 조절할 수 있는 새로운 치료 표적이 될 수 있을 것이다.
논문링크 : https://www.sciencedirect.com/science/article/pii/S0091674921015207?via%3Dihub
Development of a peptide aptamer pair-linked rapid fluorescent diagnostic system for Zika virus detection
Biosens Bioelectron, 2021

여선주 교수
(열대의학교실/의과학과)
모기 매개 질환인 지카는 2015년 브라질에서 발생한 이후 전 세계적으로 확산되고 있고, 특히 지카와 뎅기열은 발열, 피부발진, 두통 등의 유사한 증상뿐 아니라, 항원성이 유사하여 상호간 감별 진단의 어려움이 있어 모기가 많이 분포한 열대 지역에서 환자 대응의 어려움이 있다.
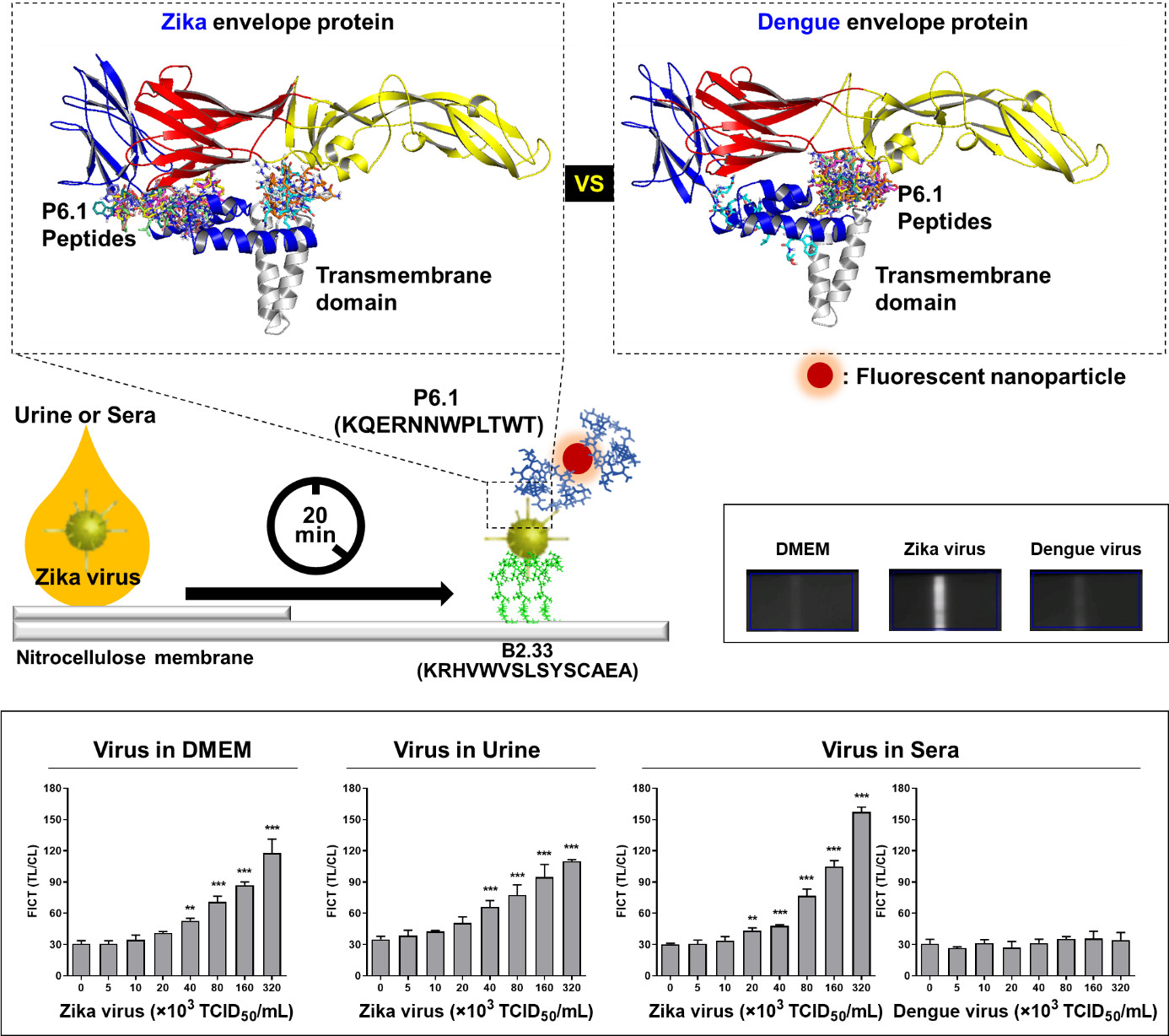
본 연구에서는 지난 5년간 펩타이드소재 기반 압타머를 개발해 온 가장 최근 성과로, 표적과 펩타이드 압타머간의 구조 기반 3차 모델링에 의해 설계된 15개 미만의 아미노산으로 이루어진 펩타이드 압타머를, 더이상 항체에 의존하지 않고 paper 기반의 신속진단키트 검사에 단독으로 활용 가능하게 개발한 연구 기술이다.
본 연구에서는 표적으로 지카 바이러스를 감염 현장에서 특이적으로 20분 안에 신속하게 검출하는 것을 목표로, 항원 검출 바이오센싱 방식으로 지카와 뎅기를 구분할 수 있는 펩타이드 소재의 압타머를 개발함으로써 기존 ELISA 방식을 탈피하고, 또한 유사한 항원성에 기인한 지카와 뎅기바이러스 감별용 특이 항체 개발의 어려움의 문제를 극복할 수 있는 것으로 확인되었고, 나아가 펩타이드 압타머 기반 신속진단시스템이 urine과 sera 임상검체에서도 안정성이 검증되어, 새로운 진단용 나노 소재로 제안할 수 있을 것으로 사료된다.
논문링크 : https://www.sciencedirect.com/science/article/pii/S0956566321008058?via%3Dihub

