[연구동향]
이민재 교수
1. Aggresomal sequestration and STUB1-mediated ubiquitylation during mammalian proteaphagy of inhibited proteasomes
Proc. Natl. Acad. Sci. USA, 2020

이민재 교수(생화학교실)
스트레스 및 노화에 의해 변성된 단백질들은 세포 내에서 빠르게 제거되어야 한다. 이러한 “쓰레기 처리” 기능은 진화적으로 잘 발전해 왔으며, 대표적으로 유비퀴틴(ubiquitin)을 매개하는 변성단백질들의 표지와 이들의 프로테아좀(proteasome)을 통한 분해가 존재한다. 이와 같은 단백질항상성 유지기전을 통하여 세포는 다양한 환경의 변화에 대응하여 생존할 수 있다. 반대로, 고장난 단백질들이 세포 내에 축적(응집)된다면 암, 퇴행성 뇌질환, 대사질환, 면역질환 등과 같은 다양한 난치병들의 원인이 될 수 있다.
세포 내 단백질 분해의 최종 수행기관인 프로테아좀은 아직까지 수동적인 분해 기계로써만 인식되고 있으며, 그 자체의 생합성이나 분해, 양적/활성적 조절기전 등에 관련된 연구는 국내외적으로도 초기단계에 머무르고 있다. 서울의대 생화학교실 소속 본 연구진은 프로테아좀 그 자체의 분해 기전을 세계최초로 포유동물 내에서 규명하고자 하였다.
우선 본 연구진은 프로테아좀은 자신의 활성이 저해되었을 때, 핵 주위의 불용성 응집소체(aggresome)내로 축적됨을 다양한 시도 끝에 발견하게 되었다 (그림 1). 이러한 이동에는 미세소관(microtubule)을 통한 수송이 주요하게 관여하였다. 그 활성이 복원되지 않았을 때, 응집소체 내의 프로테아좀은 p62를 매개한 자가포식(autophagy)에 의해 분해되었고, 새로운 정상 프로테아좀의 유전적 발현과 합성을 유도하였다. 프로테아좀이 활성을 재획득한 경우에는 응집소체에서 세포질로 빠져나와 재활용되었다 (그림 2).
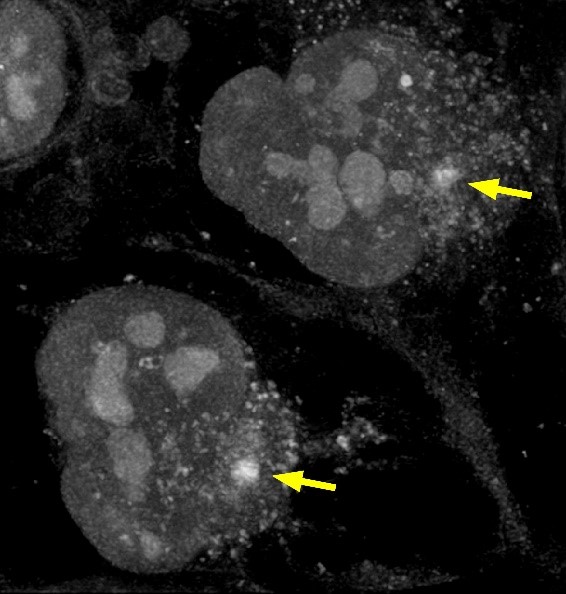
그림 1. 세포 내 굴절률을 이용한 홀로토모그래피 이미지가 응집소체(aggresome, 화살표)의 형성을 보이고 있음.
응집소체는 세포가 프로테아좀 억제제가 장시간 처리되었을 때, 핵 주위에서 나타남.
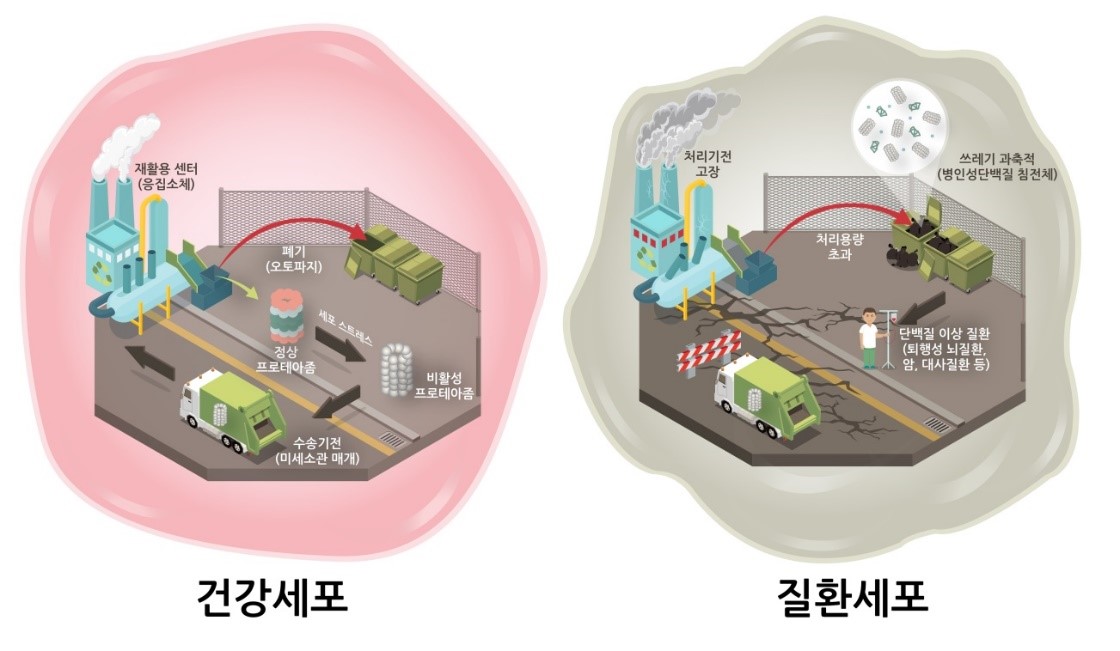
그림 2. 건강한 세포와 질환 세포 내에서 프로테아좀 품질관리 기전의 차이.
본 연구는 거대단백질 복합체인 프로테아좀이 자신의 활성변화에 따라 세포 내 위치와 용해도가 변화하고, 응집소체가 재활용센터로서 프로테아좀을 재활용하거나 자가포식을 통해 제거하는 기능을 한다는 것을 세계 최초로 밝혀내었다. 일반적인 상황에서는 프로테아좀 재생 또는 오토파지 매개 분해가 응집소체를 매개하여 활발히 일어나고 있으나, 스트레스 조건에서는, 이 기전이 제대로 작동하지 못해 병인단백질의 축적, 나아가 다양한 질환을 유도할 수 있다.
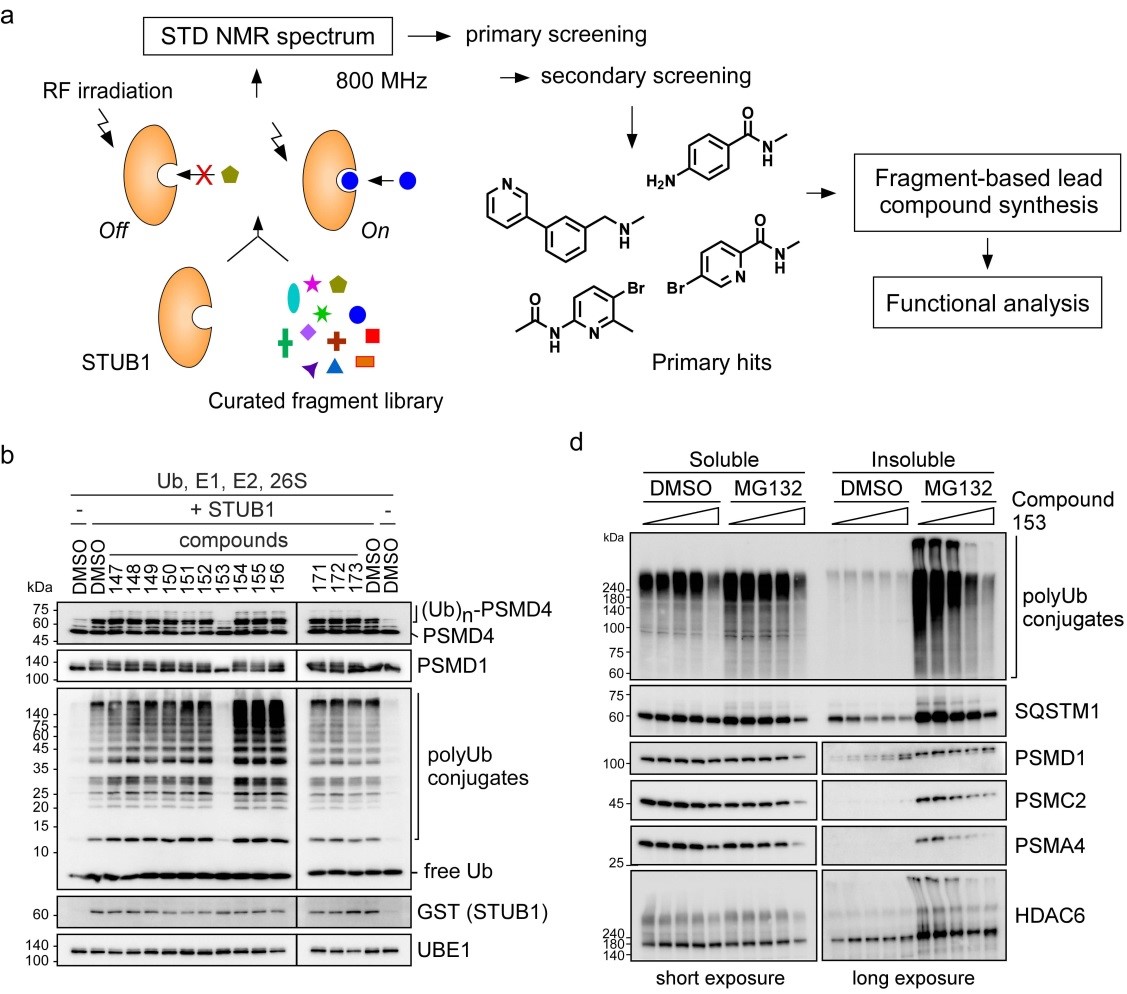
그림 3. CHIP 저분자 억제제의 스크리닝 과정의 개괄(a & b)과 최종물질(Compound #153)에 의한 프로테아좀 자체 유비퀴틴화 억제 확인 결과.
프로테아좀-응집소체-자가포식 품질관리 기전의 이해는, 이와 같은 세포 내 변화가 다양한 병인단백질의 제거와 축적에 밀접하게 연관되어 있다는 것에 일차적인 의미가 있다. 병인 단백질의 변성 및 양적증가 ⇒ 프로테아좀의 활성 저해 ⇒ 병인단백질의 축적이라는 악순환이 유도되고, 궁극적으로 응집소체의 지속적 형성과 세포기능저하, 세포사멸 등의 진행이 촉진될 수 있다. 따라서 본 연구는 프로테아좀의 양적/항상성 유지 기전을 바탕으로. 프로테아좀의 유비퀴틴화, 응집소체로의 이동경로, 자가포식의 약리적 조절 등 본 연구의 결과들이 새로운 관련 질병 치료전략 수립에 활용될 것으로 기대한다.
이승표 교수
2. Diffuse Myocardial Fibrosis and Diastolic Function in Aortic Stenosis
JACC Cardiovasc Imaging. 2020 Aug 16

이승표 교수(내과학교실) 이현정 교수(내과학교실)
대동맥판협착증은 대동맥판막의 노화로 제때에 치료하지 않으면 실신, 호흡곤란과 같은 심부전 증상 또는 급사에 이를 수 있는 질환이다. 75세 이상에서는 그 유병률이 10~15%, 이 중 수술적 치료가 필요한 중증 대동맥판협착증은 3~5%에 달하며 증상이 동반된 중증 대동맥판협착증은 치료하지 않으면 1년내 사망률이 20%를 넘는다.
한편, 대동맥판협착증은 단순한 판막질환이 아니라 좌심실이 만성적으로 높은 압력에 노출되면서 심실벽의 비후와 섬유화가 진행하는 심근질환이기도 하다. 대동맥판협착증의 치료는 노화된 판막을 수술로 대체하는 것인데 그럼에도 불구하고 심근의 비대와 섬유화는 남아 증상과 예후에 영향을 미친다. 따라서 대동맥판협착증의 최근 치료 전략은 증상이 없더라도 중증일 경우에는 조기에 수술하는 것으로 옮겨지고 있다.
심근의 섬유화 정도는 대동맥판협착증의 예후를 결정짓는 중요한 인자이나 이는 전통적으로 침습적인 조직검사를 통해서만 확인 가능하였다. 그러나 최근에는 심근 섬유화가 심근세포 사이사이의 세포 외 기질에 분포한다는 점에 착안, 가돌리늄의 약동학적 특성과 심장 자기공명영상(MRI)의 시퀀스를 이용하여 세포 외 기질의 양을 평가할 수 있는 ECV(extracellular volume index)라는 지표를 이용하여 비침습적으로 정량화할 수 있게 되었다. 본 연구팀의 이전 연구에서 ECV는 침습적으로 얻은 심근의 섬유화 정도를 매우 잘 반영하는 것으로 확인되었다.
본 연구에서는 중증 대동맥판협착증 환자들의 심장 MRI에서 계산한 ECV가 심장의 기능, 증상, 그리고 종국에는 예후와 가지는 관련성을 조사했다. 서울대학교병원과 삼성서울병원에서 중증 대동맥판막협착증 환자 191명과 일반인 30명을 대상으로 심장 MRI와 심장초음파를 시행했다. 분석 결과, ECV가 높은 환자일수록 특히 심장의 이완기능이 떨어졌으며 더 심한 호흡곤란을 보였다 (그림 1). 5년간의 추적기간 동안 ECV가 높을수록 그리고 심장의 이완기능이 감소할수록 사망과 심부전에 의한 입원율이 높았다. 특히 ECV는 기존에 알려진 대동맥판협착증의 임상적 예후인자, 좌심실의 수축기능 및 이완기능 지표들에 추가적으로 예후에 관한 정보를 제공하는 것으로 나타났다 (그림 2).
이번 연구는 향후, 중증 대동맥판협착증 환자들에서 증상이 없더라도 심장 MRI로 심근의 상태를 보다 면밀하게 평가하여 어떤 환자들을 조기 수술할 것인지에 대한 중요한 이해를 제시했다는 점에서 의미가 있다. 해당 연구 결과는 미국심장학회지 공식 이미징 저널인 'Journal of the American College Of Cardiology Cardiovascular Imaging (IF 12.74)' 8월호에 실렸으며 한국연구재단 중견연구과제의 지원으로 수행되었다 (2019R1A2C2084099).
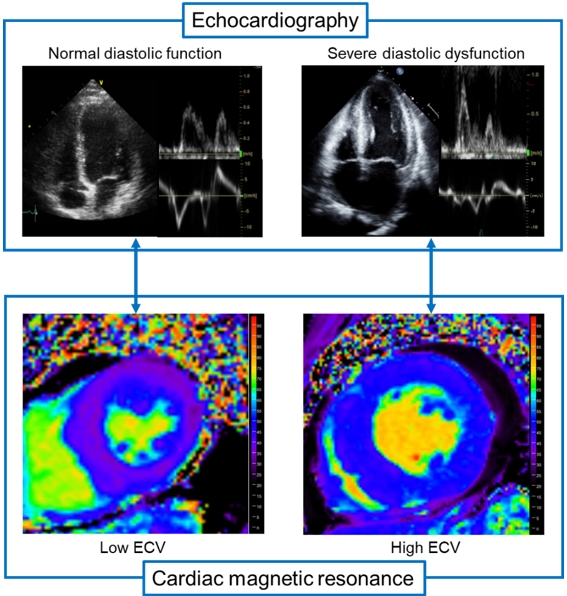
그림 1. 심근의 섬유화 지표인 ECV 가 높을수록 심장의 이완기능이 떨어졌다.
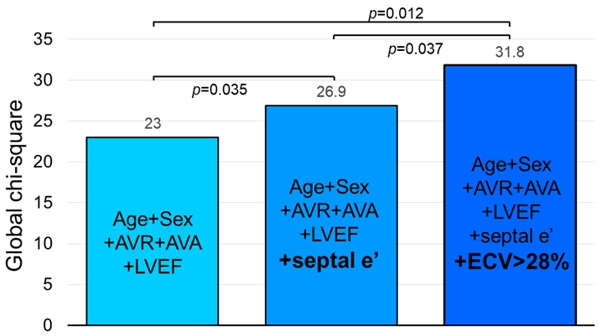
그림 2. 심근의 섬유화 지표인 ECV는 대동맥판협착증의 중증도, 임상적 예후인자, 좌심실의 수축기능 및 이완기능 지표들에 추가적으로 예후에 관한 정보를 제공하는 것으로 나타났다.
염진기 교수
3. Small proteins regulate Salmonella survival inside macrophages by controlling degradation of a magnesium transporter
Proc. Natl. Acad. Sci. USA. 2020

염진기 교수(미생물학 교실)
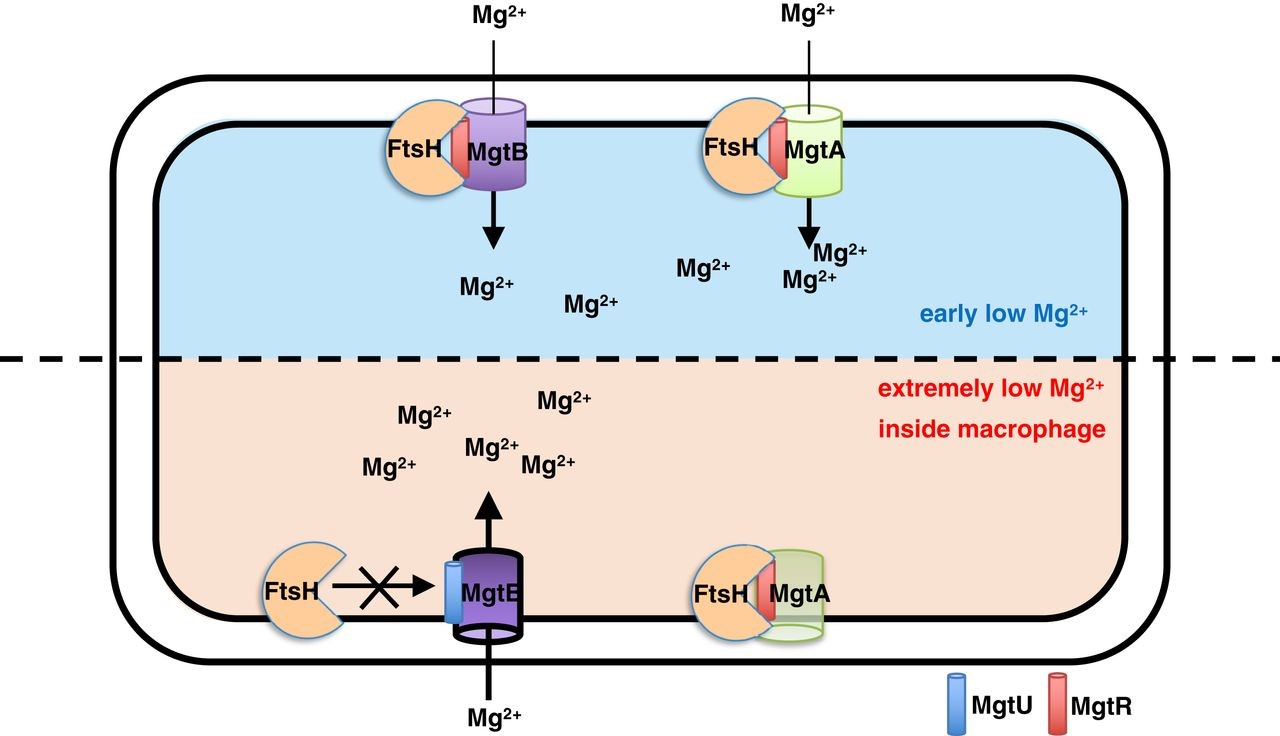
그림 1. 두 개의 단백질 조각(MgtU, MgtR)에 의한 살모넬라균 병원성에 필수적인 마그네슘 transporter MgtB 의 단백질 양 및 병원성 조절 기작

