[연구동향]
Germline gain-of-function mutation of STAT1 rescued by somatic mosaicism in immune dysregulation-polyendocrinopathy-enteropathy-X-linked-like disorder
Journal of Allergy and Clinical Immunology, 2019 Dec.

이은영 교수 (내과학교실)
희귀한 유전적 원인을 가진 면역질환들은 진단을 붙이지 못하거나, 유전적 이상소견을 발견하더라도 환자의 임상상과 연관 짓기 어려운 경우가 많다. 전장유전체서열분석 (whole genome sequencing) 기법은 유전체를 분석하는 가장 정밀한 기법임에도 불구하고 현재까지 악성종양이 아닌 질환에서 응용되는 예는 많지 않다.
서울대학교병원 류마티스내과 연구팀과 한국과학기술원 의과학대학원 주영석 교수, 이정석 전문의 연구팀은 약 4년 전부터 면역조절부전-다발성내분비병증-장병증-X염색체관련 유사질환(immune dysregulation-polyendocrinopathy-enteropathy-X-linked-like-disorder, IPEX-LD) 환자 1명을 대상으로, 특이한 병력과 돌연변이의 상관관계를 알아내기 위해 T세포를 비롯한 다양한 면역세포에서 전장유전체서열분석(whole genome sequencing)을 시행하였다.
그 결과 기존에 병인으로 지목된 STAT1 유전자의 생식세포 돌연변이(germline mutation)를 무력화할 수 있는 또 하나의 돌연변이가 체세포 모자이크(somatic mosaicism) 상태로 일부 면역세포에서 유의하게 증가했음을 발견했다. 이처럼 기능적으로 정상화된 일부 면역세포들이 비정상의 대부분 면역세포들에 비해 증식력에서 비교우위를 가짐으로써 지배적인 클론이 되고, 자가면역현상의 원인을 제공했을 가능성을 확인하였다. 이 연구는 정교한 전장유전체서열분석과 이에 기반한 면역학적 해석이 희귀 및 극희귀질환의 병인을 밝히고 임상상을 설명하며, 나아가 치료에 대한 타깃을 찾는데 기여할 수 있음을 제시하였다.
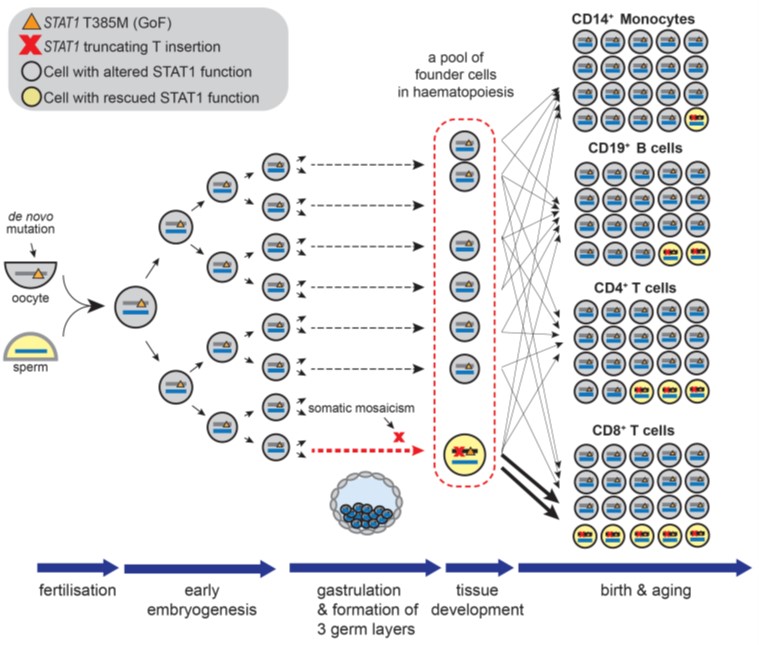
IPEX-LD 환자의 일생 동안 발생한 STAT1 돌연변이의 과정
논문링크 : https://www.jacionline.org/article/S0091-6749(19)31619-7/abstract
Structural heterogeneity of α-synuclein fibrils amplified from patient brain extracts
Nature Communications, 2019 Dec.

이승재 교수(의과학과)
파킨슨병(Parkinson Disease)과 다계통위축(Multiple System Atrophy)은 운동장애를 수반하는 대표적 퇴행성 신경질환이다. 이들 질환은 병리학적으로 모두 알파-시뉴클린 단백질의 응집체 축적으로 특징지어지는데, 하나의 단백질 응집체가 어떻게 두 개의 다른 질환을 일으킬 수 있는지에 관하여 아직 알려지지 않았다. 이 문제를 설명하기 위하여 이 분야의 연구자들이 가장 선호하는 가설은 파킨슨병과 다계통위축에서 발생하는 알파-시뉴클린 응집체의 구조가 차이가 있으며 이러한 구조적 차이에 의하여 각각 다른 병리작용을 일으킨다는 아이디어이다. 이 가설을 검증하기 위하여, 본 연구팀은 독일 막스플랑크 연구소의 Markus Zweckstetter 박사팀과 호주 시드니대학의 Glenda Halliday 교수팀과 공동연구를 통하여 파킨슨병 환자와 다계통위축 환자의 뇌에서 알파-시뉴클린의 응집체를 증폭하여 이들 응집체의 구조를 형광프로브와의 결합, 핵자기공명, 전자 상자성공명을 분석함으로써 각 질환에서 유래된 응집체의 구조를 분석하였다. 또한, 이러한 환자 유래 응집체의 구조를, 지금껏 여러 연구자들이 사용하였던 in vitro 유래 응집체의 구조와 비교 분석하였다. 그 결과, 환자 유래 응집체는 in vitro 응집체와 구조적으로 상당한 차이를 보였으며, 환자 간에도 미묘한 차이를 보였다. 그리고 파킨슨병 유래 응집체와 다계통위축 유래 응집체는 뚜렷한 구조적 시그니쳐를 보이지 않았으나, 파킨슨병 응집체의 경우 더 구조적 다양성이 큰 경향을 보였다. 본 연구는 최초로 파킨슨병과 다계통위축 환자에서 유래된 알파-시뉴클린 응집체의 구조를 높은 해상도로 분석한 연구로서, 이들 환자 유래 응집체는 연구자들이 흔히 실험실에서 만드는 응집체와는 구조가 상이하다는 것을 보였으며, 응집체의 구조만으로는 파킨슨병과 다계통위축의 발병 경로의 차이를 설명할 수 없음을 제안하였다.
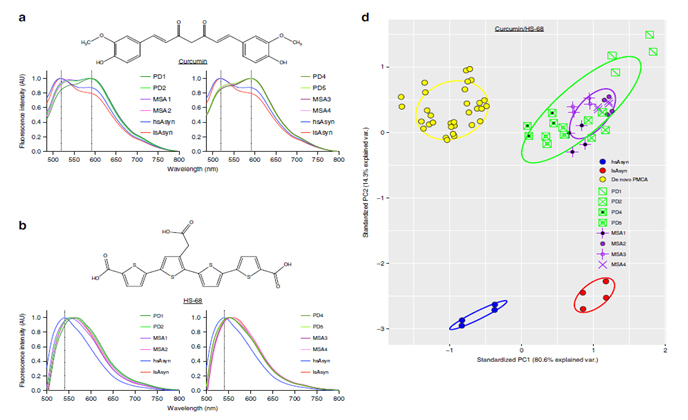
형광프로브와의 결합 차이를 통한 구조분석
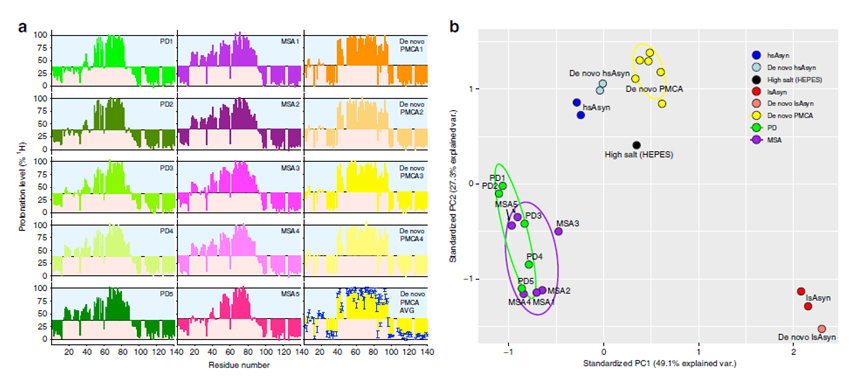
핵자기공명을 이용한 환자 유래 알파-시뉴클린 응집체의 구조 분석
Assessment of Inflammation in Pulmonary Artery Hypertension by 68Ga-Mannosylated Human Serum Albumin
American Journal of Respiratory and Critical Care Medicine, 2020 Jan.

이승표 교수(서울대학교병원 내과)
폐동맥고혈압은 특별한 이유 없이 폐세동맥이 좁아지는 질환이다. 폐동맥 압력이 상승해 우심실 기능이 저하되고 혈액이 심장에서 폐로 원활하게 전달되지 않아 호흡곤란, 심부전, 사망에 이를 수 있다. 최근 여러 약제의 꾸준한 개발에도 폐동맥고혈압의 5년 생존율은 50% 정도에 불과하다. 예후가 매우 나쁘기 때문에 적절한 조기진단과 치료가 중요하다.
서울대학교병원 순환기내과, 핵의학과 공동연구팀이 주목한 것은 폐동맥고혈압의 처음 시초가 환자의 폐혈관에 나타나는 염증반응이라는 것이었다. 염증반응을 영상으로 시각화, 수치화한다면 폐동맥고혈압의 발병여부 및 정도를 확인할 수 있다는 가설을 세우고 이를 증명하였다. 염증반응은 대식세포의 침윤 정도로 판단하였으며 대식세포 표면의 mannose 수용체를 추적하는 68Ga-NOTA-MSA라는 알부민-기반 합성물질을 표지자로 폐동맥고혈압에 동반하는 염증반응을 추적하였다. 폐동맥고혈압 동물 모델 및 실제 폐동맥고혈압 환자들의 임상시험 결과, 폐동맥고혈압에서 건강한 대조군에 비해 폐의 염증 정도가 유의하게 높다는 것을 비침습적으로 확인할 수 있었다 (그림).
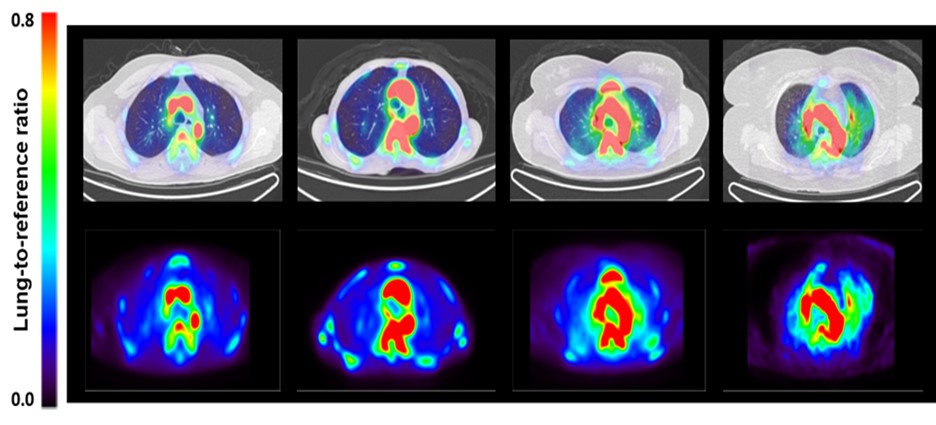
건강한 대조군 (좌단의 두 그림)에 비하여 폐동맥고혈압 환자 (우단의 두 그림)에서 폐의 68Ga-NOTA-MSA 축적 정도를 PET으로 영상화한 그림.
이번 연구는 폐동맥고혈압 조기발견 가능성과 치료 경과를 비침습적으로 추적할 수 있다는 점에서 의미를 가진다. 이번 연구는 한국보건산업진흥원과 과학정보통신기술부의 지원을 받았으며 미국흉부학회 공식잡지 ‘American Journal of Respiratory and Critical Care Medicine’ (2018년 Impact factor 16.494)’ 최근호에 게재됐다.
논문링크 : https://www.atsjournals.org/doi/10.1164/rccm.201903-0639OC

