[연구동향]
Non-invasive in vivo imaging of caspase-1 activation enables rapid and spatiotemporal detection of acute and chronic inflammatory disorders
Biomaterials. 2019

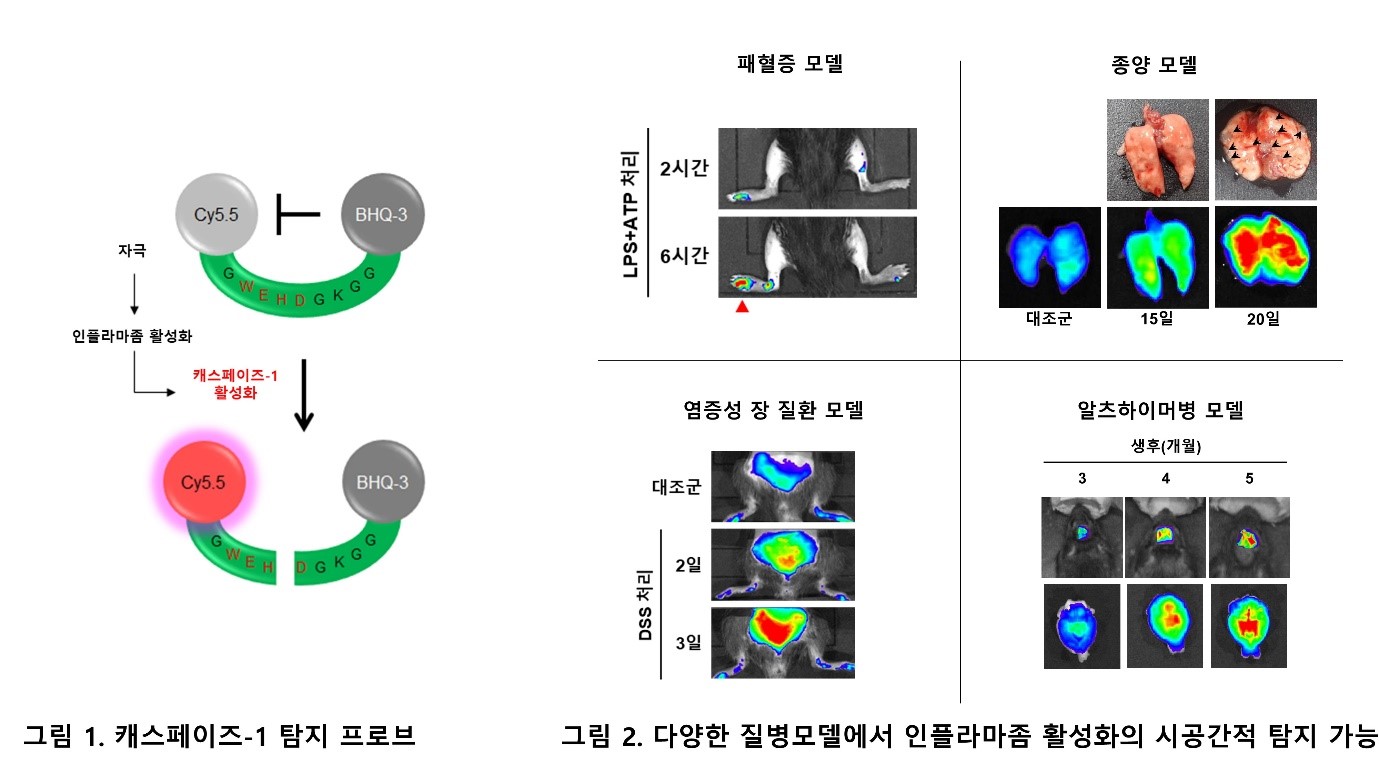
우리 몸에서는 감염이나 다양한 스트레스에 의해 선천면역 반응이 일어나게 되며, 이 때 단백질 복합체인 인플라마좀(inflammasome)이 형성 된다. 인플라마좀은 캐스페이즈-1 (caspase-1)을 활성화하여 염증성 싸이토카인 인터루킨-1β (IL-1β) 및 인터루킨-18 (IL-18) 분비를 유도한다. 최근 연구들에 따르면, 인플라마좀의 활성이 대사성질환, 퇴행성 신경질환 같은 다양한 질병들의 발생과 진행에 관여하고 있다는 사실이 알려지고 있으며, 그 활성을 측정할 수 있는 기술은 이러한 질환들의 조기 진단에 활용될 수 있을 것으로 기대되고 있다. 하지만 아직까지 생체내에서 인플라마좀의 활성을 비침습적 방법으로 실시간 모니터링하는 기술이 개발되지 않았다.
서울대학교 의과대학-KIST 공동연구팀은 이번 연구를 통해 인플라마좀의 활성화를 특이적으로 감지할 수 있는 캐스페이즈-1 탐지 프로브를 고안하였다 (그림 1). 또한, 패혈증, 염증성 장질환, 종양, 알츠하이머병 동물 모델에서 발병 초기에, 개발된 캐스페이즈-1 탐지 프로브을 이용하여 인플라마좀의 활성화를 실시간 이미징으로 모니터링할 수 있는 기술을 개발하였다. 이를 통해 염증 발생의 시점과 부위를 비침습적으로 확인할 수 있었다 (그림 2). 특히 염증성 장질환의 경우, 증상발현(6일; 체중 감소, 혈변)이 나타나기 4일 전에 캐스페이즈-1 프로브를 이용하여 장에서의 염증 발생을 탐지할 수 있었다. 알츠하이머병 마우스 모델의 경우, 인지기능 손상 (5개월령)이 나타나기 전, 3개월령 마우스의 뇌 내 인플라마좀 활성화를 탐지할 수 있었다. 이러한 결과는 개발된 캐스페이즈-1 프로브가 향후 초기 진단이 어려운 질병(암, 알츠하이머병)의 비침습적 조기 진단과 치료반응 등을 모니터링할 수 있는 신기술 개발에 활용될 수 있음을 시사한다.
논문 링크
https://www.sciencedirect.com/science/article/pii/S0142961219306428?via%3Dihub
Prognostic plasma protein panel for Aβ deposition in the brain in Alzheimer’s disease
Prog Neurobiol. 2019

알츠하이머병은 전 세계 치매의 약 70% 정도를 차지하는 대표적인 퇴행성 뇌 질환이다. 알츠하이머병은 뇌 속 베타-아밀로이드라는 단백질의 축적으로 인해 뇌세포가 손상되어 병이 진행되는 것으로 알려져 있다. 특히 중증환자가 아닌 기억력에 이상을 호소하는 경도인지장애 환자군의 경우, 그 중 50% 정도는 뇌 속에 베타-아밀로이드가 축적되는 알츠하이머병으로 진행된다고 알려져 있다. 본 연구는 단백질체학 분석을 통하여 뇌 속 베타-아밀로이드의 축적 정도에 따라 변화하는 혈액 내 후보 단백질 4종을 발견하고 (그림 A), 이 4가지 바이오마커 물질을 통하여 경도 인지장애 환자군의 혈액 내 해당 농도를 측정하였으며, 이를 통해 환자들의 뇌 속 베타-아밀로이드 축적 여부를 예측하였다. 바이오마커의 예측 정확도는 83.6%에 달했으며, 현재 뇌 속 베타-아밀로이드를 영상으로 촬영하는 Pittsburgh compound B (PiB) 양전자 방출 단층촬영 (PET) 결과와 상당히 높은 유사도를 보였다 (그림B-D). 본 연구결과가 실용화되면 간단한 혈액 검사로도 경도인지장애 환자의 알츠하이머병으로의 진행 여부를 예측할 수 있을 것이며, 이는 조기치료를 통한 치매 예방과 진행의 억제에 큰 도움이 될 것이라고 예상하는 바이다.
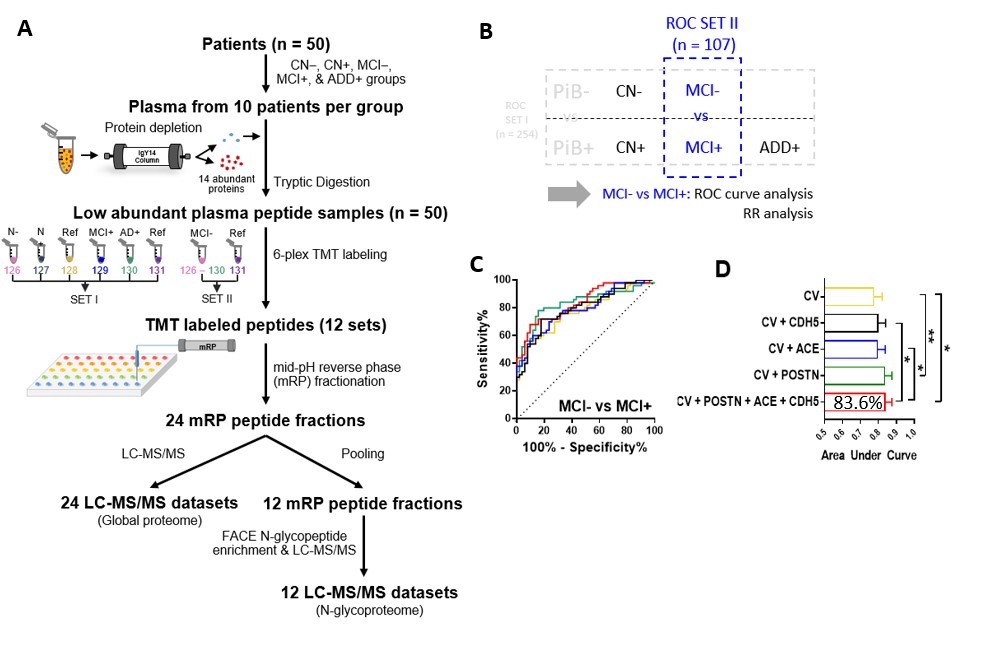
경도인지장애 대상 뇌 베타-아밀로이드 예측 혈액 바이오마커 발굴
논문링크
https://www.sciencedirect.com/science/article/pii/S0301008219301194?via%3Dihub
CRISPR-Cas9-mediated therapeutic editing of Rpe65 ameliorates the disease phenotypes in a mouse model of Leber congenital amaurosis
Sci Adv. 2019.

서울대학교병원 안과 김정훈 교수 연구팀은 레버선천흑암시를 지닌 생쥐에게 유전자교정물질을 전달해 유전자 돌연변이를 완전히 교정하는데 성공했다.
레버선천흑암시란 시각기능과 관련된 유전자(RPE65, CEP290 등)의 돌연변이로 인해 발생하는 대표적인 선천망막질환이다. 출생 시 선천적인 실명을 일으킬 수 있는 유전성 망막 이상으로, 시각장애 특수학교 어린이 10~18%가 해당 질병을 앓고 있다.
연구팀은 돌연변이RPE65 유전자를 가진 rd12생쥐의 망막하 공간에 크리스퍼 유전자가위와 정상RPE65 유전자를 탑재한 아데노연관바이러스 벡터를 주사했다. 그 결과, rd12생쥐의 망막색소상피세포에 정상RPE65 단백질이 합성됐다. 치료 후 6주, 7개월 뒤 시행된 두 차례의 망막전위도검사에서도 rd12생쥐의 시각반응은 정상적인 생쥐의 20% 수준으로 높아졌고, 망막신경세포층의 두께도 회복됐다.
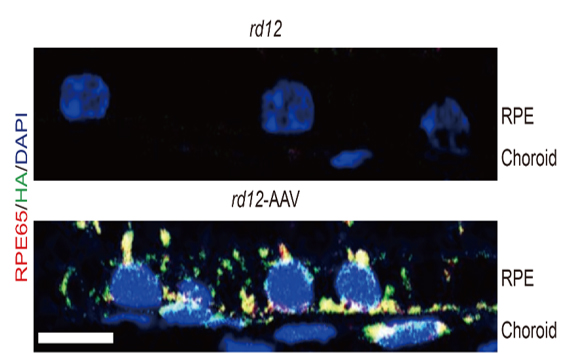
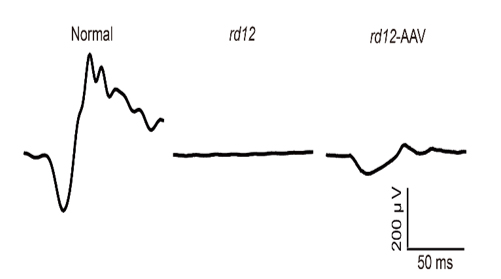
이번 연구의 의의는 크게 두 가지이다. 첫째로, 유전자 돌연변이를 완전히 교정했다는 점이다. 사실 아데노연관바이러스 유전자 치료제를 주입하는 방법은 이미 레버선천흑암시 환자 치료에 활용되고 있다. 다만 주입 후에도 돌연변이 유전자가 세포 내에 그대로 존재한다는 한계가 있고 환자가 명확한 치료를 받지 못한 채 실명에 이르는 경우도 많았다. 연구팀은 크리스퍼 유전자가위를 활용해 돌연변이 유전자를 완전히 교정할 수 있다는 것을 증명했다. 레버선천흑암시를 비롯한 선천망막질환을 더 근본적으로 치료할 수 있는 가능성이 열린 것이다. 둘째로, 이번 연구에선 비표적 효과로 인한 부작용이 없었다. 비표적 효과란 쉽게 말해 원래 목표가 아닌 엉뚱한 유전자를 인식해 발생하는 현상이다. 이번 연구에서 비표적 효과가 나타난 부위는 전체 DNA중 10개 미만으로 아주 적었으며, 7개월 뒤 시행된 조직 검사에서도 아무런 이상이 없는 것으로 나타나, 치료의 안전성을 시사했다.
논문 링크
https://advances.sciencemag.org/content/5/10/eaax1210

