[연구동향]
A breakdown in metabolic reprogramming causes microglia dysfunction in Alzheimer’s disease.
Cell Metabolism 2019

백성훈 박사후 연구원(제1저자) 강석조 박사후 연구원(제1 저자) 묵인희 교수(생화학교실, 교신저자)
뇌 면역세포인 미세아교세포는 평상시 주변을 탐지·보수하는 신경교세포인 알츠하이머병의 주요 원인물질 중의 하나인 베타 아밀로이드 단백질을 감지하면 활성화되어 베타 아밀로이드 단백질을 포식·분해하는 청소부 역할을 한다. 연구팀은 미세아교세포에 급성으로 베타아밀로이드가 노출되었을 때 세포는 미토콘드리아를 통한 산화적 인산화 (OXPHOS)로 에너지를 만드는 것 보다 에너지 효율이 빠른 해당작용 (glycolysis)을 선택하는 에너지 대사 재편성과정 (metabolic reprogramming)을 통해 빠르게 활성화가 일어난다. 이런 활성화는 세포 포식작용 (Phagocytosis)을 하여 세포 내 존재하는 응집된 베타아밀로이드를 제거하는 역할을 하며 다양한 염증성 사이토카인을 분비하게 된다. 반면에 만성적으로 베타아밀로이드에 미세아교세포가 노출된 경우에는 정상적인 세포의 대사과정인 미토콘드리아에 의한 에너지 생성이나 해당작용을 통한 에너지 생성 모두가 작용을 하지 못하게 되면서 미세아교세포의 고유기능을 잃어버리게 된다. 이것을 감마인터페론을 주입하여 다시 회복시킬 수 있음을 확인하였다.
이번 연구결과는 알츠하이머병에서 뇌 면역세포인 미세아교세포가 어떤 세포내 대사과정을 이용하여 뇌 내의 베타 아밀로이드를 제거하는지를 규명하였으며 미세아교세포의 대사촉진을 통해 알츠하이머병과 같이 응집체가 뇌 내에 축적되는 퇴행성 신경질환의 새로운 치료 전략을 제시한 것으로 평가된다.
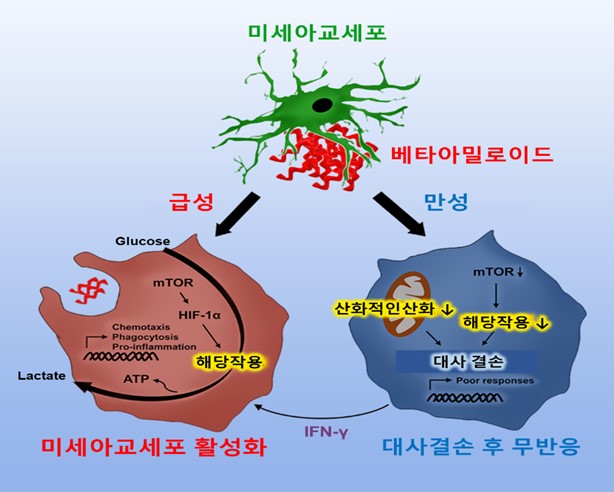
<Graphical abstract>
<논문링크>
https://www.sciencedirect.com/science/article/pii/S1550413119303080?via%3Dihub
Integrative analysis of genomic and transcriptomic characteristics associated with progression of aggressive thyroid cancer
Nature communications 2019

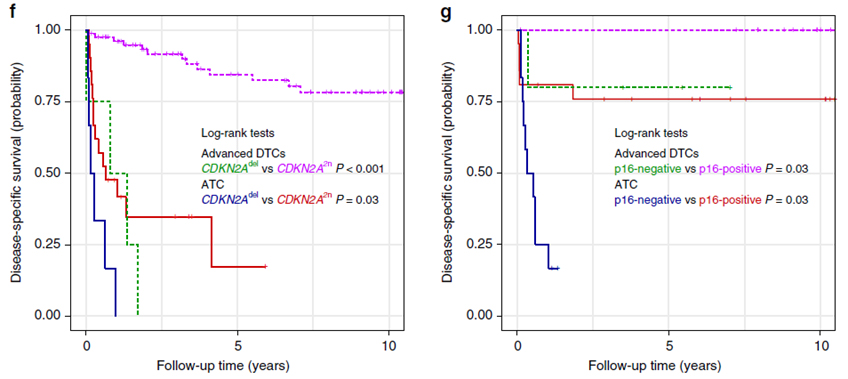
미분화 갑상선암은 조기에 진단하지 못하면 치료가 거의 불가능해 발병 시 1년 안에 사망한다고 알려진 질병이다. 따라서 미분화 갑상선을 조기에 진단하고 치료의 타겟이 되는 분자유전학적 지표의 발굴이 이들의 생존률 향상에 매우 중요하다. 기존에 일부 조기 진단에 사용될 수 있는 바이오마커들이 제시되었지만, 대부분 유전자 변이에 국한되고 유전자 발현량 등의 지표들에 대해서는 알려진 바가 거의 없었다. 서울의대 생화학교실 서정선 명예교수와 내과학교실 박영주 교수 연구팀은 미분화 갑상선 포함한 진행성 갑상선암 113례의 유전자 변이와 25례의 전사체 분석을 통해 조기진단 및 치료 대상을 발굴하여 최근 발표하였다. 이를 통해 CDKN2A 유전자 결실과 p16 단백질 발현이 미분화 갑상선암 및 진행성 분화 갑상선암 환자의 생존률에 크게 영향을 미치는 것을 발견하였고 (그림 1) JAK-STAT 신호전달경로의 활성화가 미분화갑상선암의 치료 타겟이 될 수 있음을 제시하였다. (그림 2) 해당 연구결과를 통해 임상에서 미분화갑상선암의 조기 진단에 큰 도움이 될 것으로 기대된다.
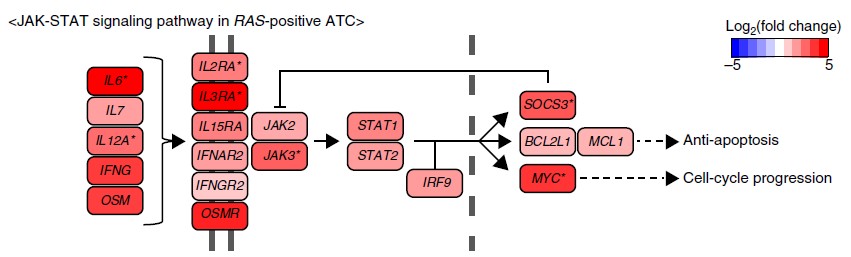
<그림 2. 미분화 갑상선암에서의 JAK-STAT 신호전달 경로 활성화>

