[연구동향]
Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma
Cell. 2019

폐암은 전 세계 암 사망원인 1위를 차지하는 무서운 암으로, 흡연에 의해 많이 발생한다, 그러나 비흡연자에서도 폐암이 발생하는데 이러한 경우 상피세포 성장인자 수용체 (EGFR) 돌연변이 또는 융합유전자의 생성이 주된 원인으로 알려져 있다. 폐암의 원인이 되는 융합유전자는 ALK, RET, ROS1 등 많은 유전자가 발견되었는데, 특히 서울대학교 의과대학 흉부외과–유전체연구소 공동연구팀은 2012년 RET 융합유전자의 발생을 학계에 세계 최초로 보고한 바 있다. 하지만 어떠한 기전으로 융합유전자가 만들어지는지는 이제까지 거의 알려져 있지 않았다.
서울대학교 의과대학 흉부외과-KAIST 공동연구팀은 전장유전체 빅데이터의 정밀생명정보학 분석을 이용해 융합유전자의 발생 기전을 분석하였다. 연구 결과 70% 이상의 융합유전자는 복잡구조변이에 의해 발생하는데 이러한 구조 변이는 암이 되기 전 정상세포에서 흡연과 상관 없이 발생함을 확인하였다(그림 1). 또한 인간 세포에 일정한 속도로 쌓이는 점돌연변이를 이용하여 마치 지질학의 연대 측정을 하는 것과 비슷한 방법으로 융합유전자의 발생 시점을 추정하였더니 놀랍게도 폐암 진단을 받기 전 수십 년 전, 심지어는 10대 이전의 나이에서도 암을 일으키는 융합유전자가 발생할 수 있다는 증거를 확인하였다. 이는 세포가 암 발생 돌연변이를 획득한 후 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적 되어야 함을 의미한다(그림 2). 이러한 결과는 폐암의 발생 기전에 대한 새로운 지평을 제시하였고, 폐암 예방 및 치료법 개발에 중요한 단서를 제공할 것으로 기대된다.
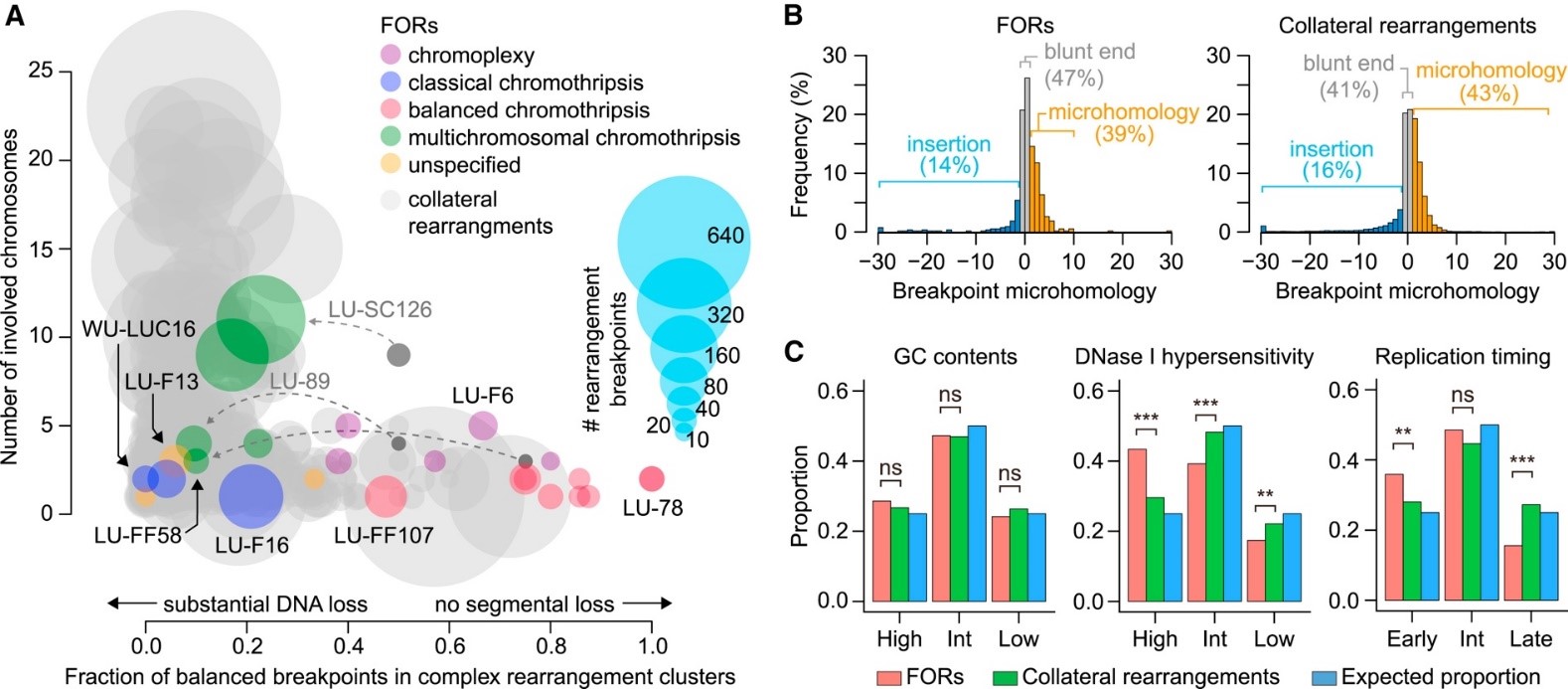
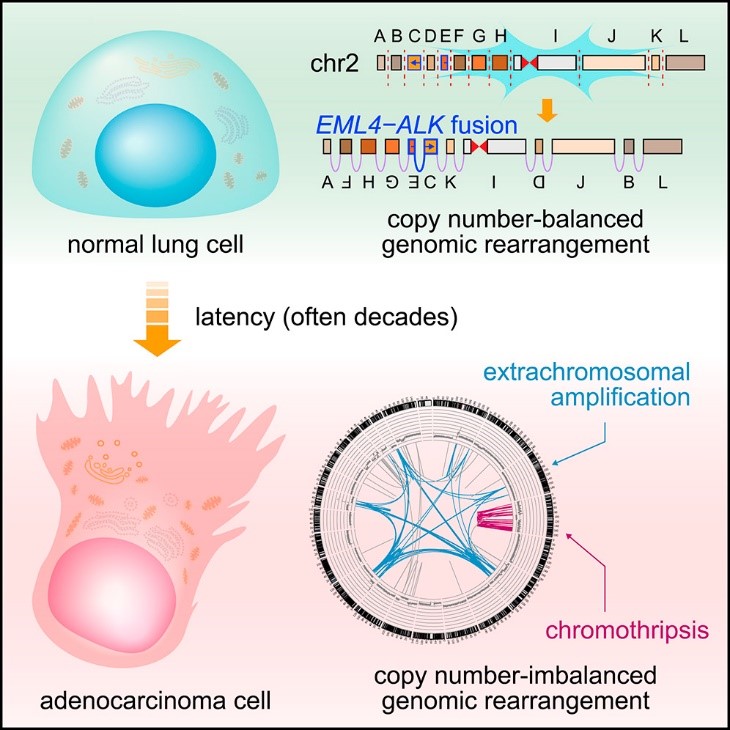
논문링크 : https://www.sciencedirect.com/science/article/pii/S0092867419305112?via%3Dihub
Prognostic Implications of Plaque Characteristics and Stenosis Severity in Patients with Coronary Artery Disease
J. Am. Coll. Cardiol. 2019

관상동맥 협착병변에 대한 평가 및 적절한 치료 방침 결정은 의학뿐만 아니라 사회경제적으로 매우 중요하다. 관상동맥 질환이 의심되는 경우 일반적으로 외래에서 비관혈적 검사를 시행하고 유의한 협착이 의심되는 경우 관혈적 관상동맥 조영술을 시행한다. 이 과정에서 얻어진 의학정보를 환자예후나 최종 치료 방침 결정에 어떻게 통합적으로 적용할 수 있을지는 잘 알려져 있지 않다.
서울대학교 병원 순환기내과 연구팀은 이러한 문제에 대한 해답을 얻기 위해 지속적으로 연구를 진행해 왔으며 이번 논문을 통해 관상동맥 조영술 전 시행한 CT검사의 정보로 협착병변이 심근허혈의 유발여부 및 환자의 예후를 더 잘 예측할 수 있고 치료 방침결정에 도움이 된다는 결과를 보고하였다(그림). 이 연구결과는 임상의사들이 관상동맥 질환이 있는 환자들에 대한 적절한 치료방침을 결정하는데 도움을 줄 것으로 기대된다.
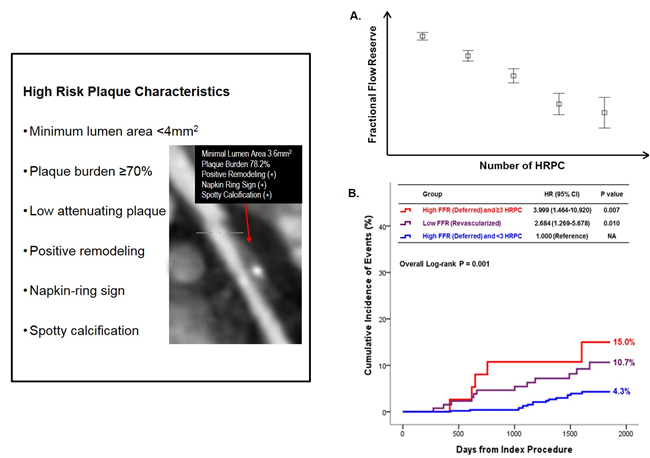
논문링크 : http://www.onlinejacc.org/content/73/19/2413.abstract
Nasal commensal Staphylococcus epidermidis enhances interferon-λ-dependent immunity against influenza virus
Microbiome. 2019

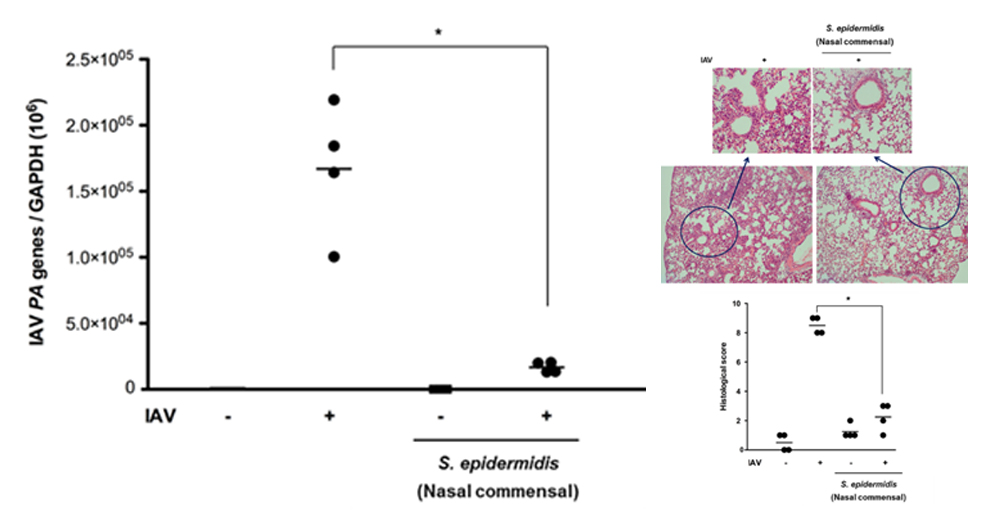
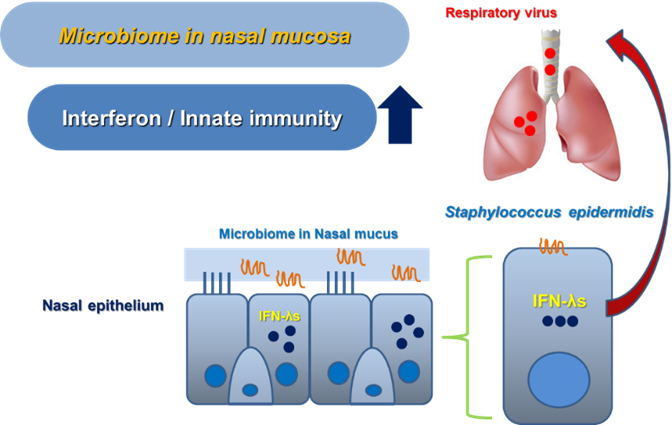
최근 인체에 감염상태가 아닌 정상적인 상태에서도 존재하는 공생미생물의 존재 및 그 역할에 대한 연구가 많은 관심을 끌고 있고 많은 연구자들이 공생미생물에 대한 연구를 진행하고 있다. 주로 장내 미생물에 대한 연구가 많이 진행되고 있는데 본 연구자는 호흡기 점막 특히 코 점막에 존재하는 공생미생물에 대해 관심을 갖게 되었다. 사람의 호흡기상피와 점막은 병원균, 바이러스 등의 미생물들과 직접 접촉하게 되는 인체의 타겟 조직으로 진화되었으며 약 3000마리 이상의 공생미생물이 상재하고 있다. 본 연구에서는 정상인의 코 점막에 적응하여 생존하고 있는 공생미생물 중에서 가장 많이 분포하고 있는 Staphylococcus epidermidis를 정상인의 코점막에서 분리 배양하였다(그림 1).
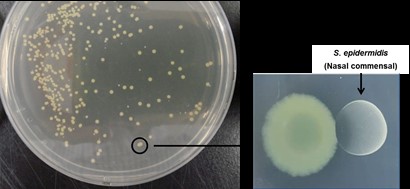
현재 정상인 17명에서 분리한 Staphylococcus epidermidis를 보유하고 있으며 이 공생미생물이 코상피세포와 마우스 모델에서 인터페론 람다 (Interferon-lambda)의 분비를 유도하여 인플루엔자 바이러스의 상기도 및 폐 감염을 억제 시킬 수 있음을 본 연구를 통해 증명하였다(그림 2). 결국 코 점막에 존재하는 공생미생물, 특히 Staphylococcus epidermidis는 코 점막 선천성 면역기전의 강화를 통해 폐의 병원균 억제 및 면역력 항진 기능을 한다고 생각되며 인체에 적응하여 생존하고 있는 공생미생물을 통한 새로운 호흡기 점막 면역강화 기전 규명 및 호흡기 바이러스 감염의 새로운 치료에 대한 연구근거를 제시 할 수 있을 것으로 판단된다.
Graphical abstract
논문링크 : https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-019-0691-9
Establishment of Novel Intraoperative Monitoring and Mapping Method for the Cavernous Nerve During Robot-assisted Radical Prostatectomy: Results of the Phase I/II, First-in-human, Feasibility Study
Eur Urol. 2019

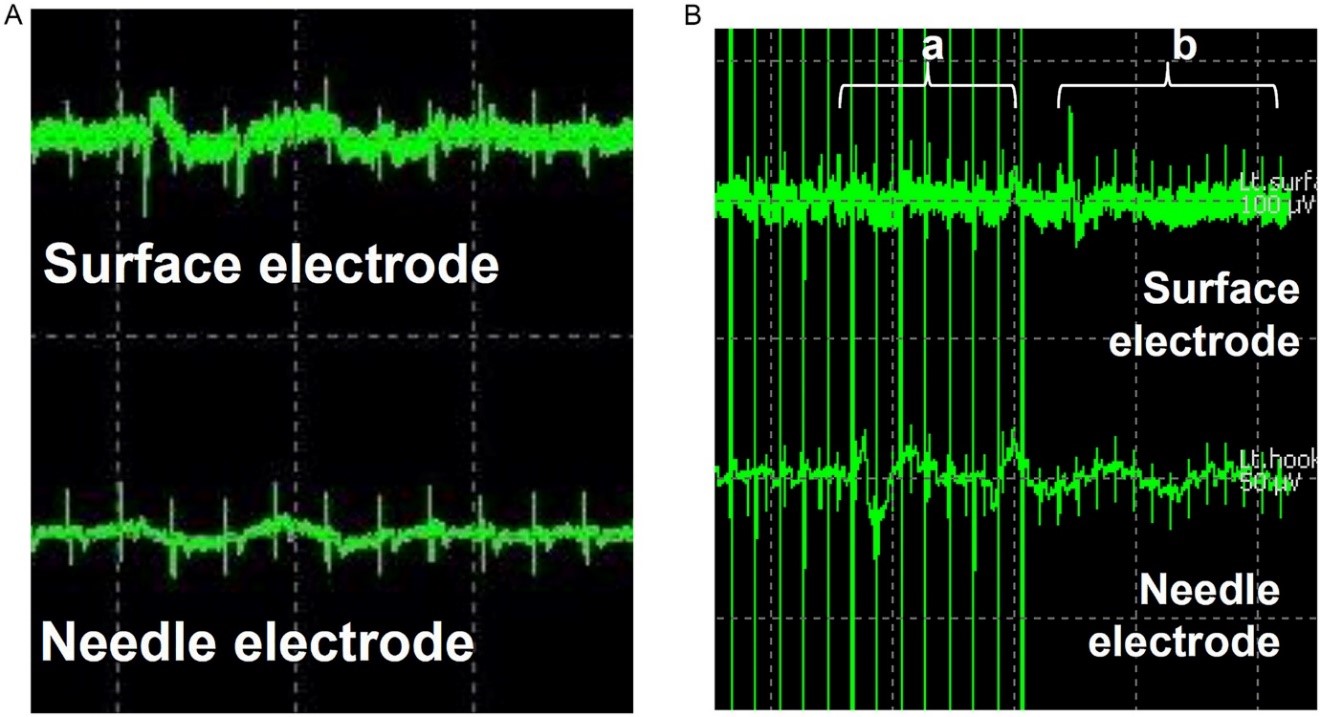
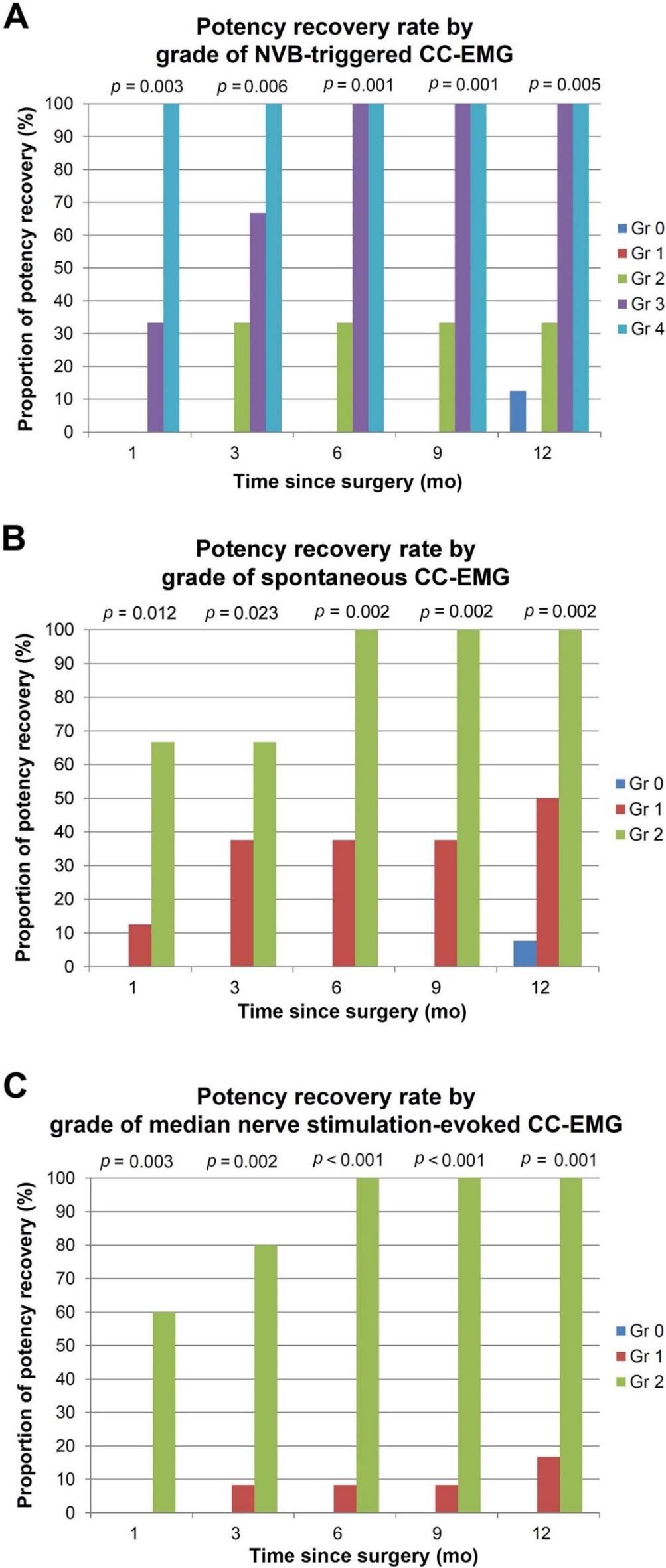
전립선암의 가장 흔한 치료법인 근치적전립선적출술은 수술 후 매우 흔하게 발기부전을 유발한다. 발기를 관장하는 음경해면체신경을 보존하는 수술 방법을 시행하고 있지만, 눈에 보이거나 측정되지 않아 그 결과가 만족스럽지 못하다. 서울대학교병원 비뇨의학과 연구팀은 재활의학과를 비롯, 신경과, 마취통증의학과와 함께 다학제 연구를 통해 음경해면체신경 전기자극을 통한 음경해면체근전도(그림 1)를 측정하는 방법 및 이를 이용한 수술 중 음경해면체신경의 위치를 확인하고 모니터링 하는 수술 방법을 세계 최초로 확립하였다. 또한 로봇근치적전립선적출술에 적용한 최초의 사람 대상, 제 1/2상, 전향적 임상시험을 통해 전립선 적출 전 음경해면체근전도 결과가 수술 전 환자의 발기력과 유의한 상관관계가 있으며, 전립선 적출 후 음경해면체근전도 결과는 수술 후 발기력 회복과 유의한 상관관계가 있음을 보여 임상적으로 매우 유용한 수술 중 신경 모니터링 방법임을 증명하였다(그림 2). 향후 본 신경 모니터링 방법을 적용하여 전립선암 수술 후 발기력 보존이 획기적으로 개선될 것을 기대하면서 대규모 임상시험을 준비 중이다.
논문링크 : https://www.sciencedirect.com/science/article/pii/S0302283819303598?via%3Dihub
Pre-clinical Modeling of Osimertinib for Non-small Cell Lung Cancer with EGFR Exon 20 Insertion Mutations
J. Thorac. Oncol. 2019

EGFR 엑손 20 삽입 돌연변이는 비소세포폐암의 EGFR 돌연변이 중 세 번째로 흔하지만, 엑손 20 삽입 돌연변이 부위는 그림 1과 같이 다양하게 존재하고 현재까지 뚜렷한 표준치료방법이 없다. 따라서, 서울대학교병원 혈액종양내과 김태민 교수 연구팀은 이러한 EGFR 엑손 20 삽입 돌연변이가 존재하는 환자 유래 암세포주 및 다양한 부위의 엑손 20 삽입 돌연변이가 있는 모델을 구축하여(그림 1), 1~3세대의 EGFR 표적치료제들에 대한 효능을 확인하였다. 이를 통하여, 3세대 EGFR 표적치료제인 osimertinib 이 가장 우월한 효능을 보이면서, 엑손 20 삽입 돌연변이에 잘 결합하는 것을 밝혔다(그림 2). 하지만, osimertinib의 경우 다양한 획득 내성이 발생하여 치료 효과를 저해한다는 내용도 동시에 밝혀 현재 진행 중인 임상에 대한 근거 및 향후 치료에 대한 방향성을 제시하였다

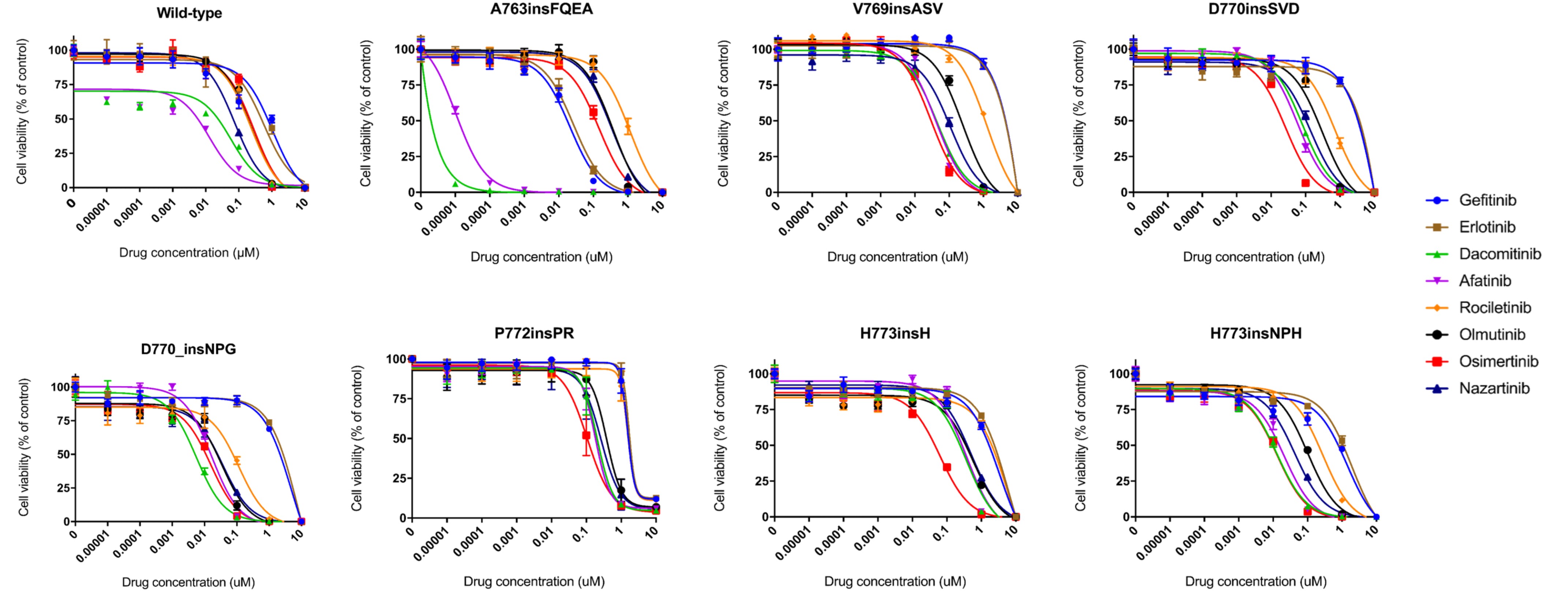
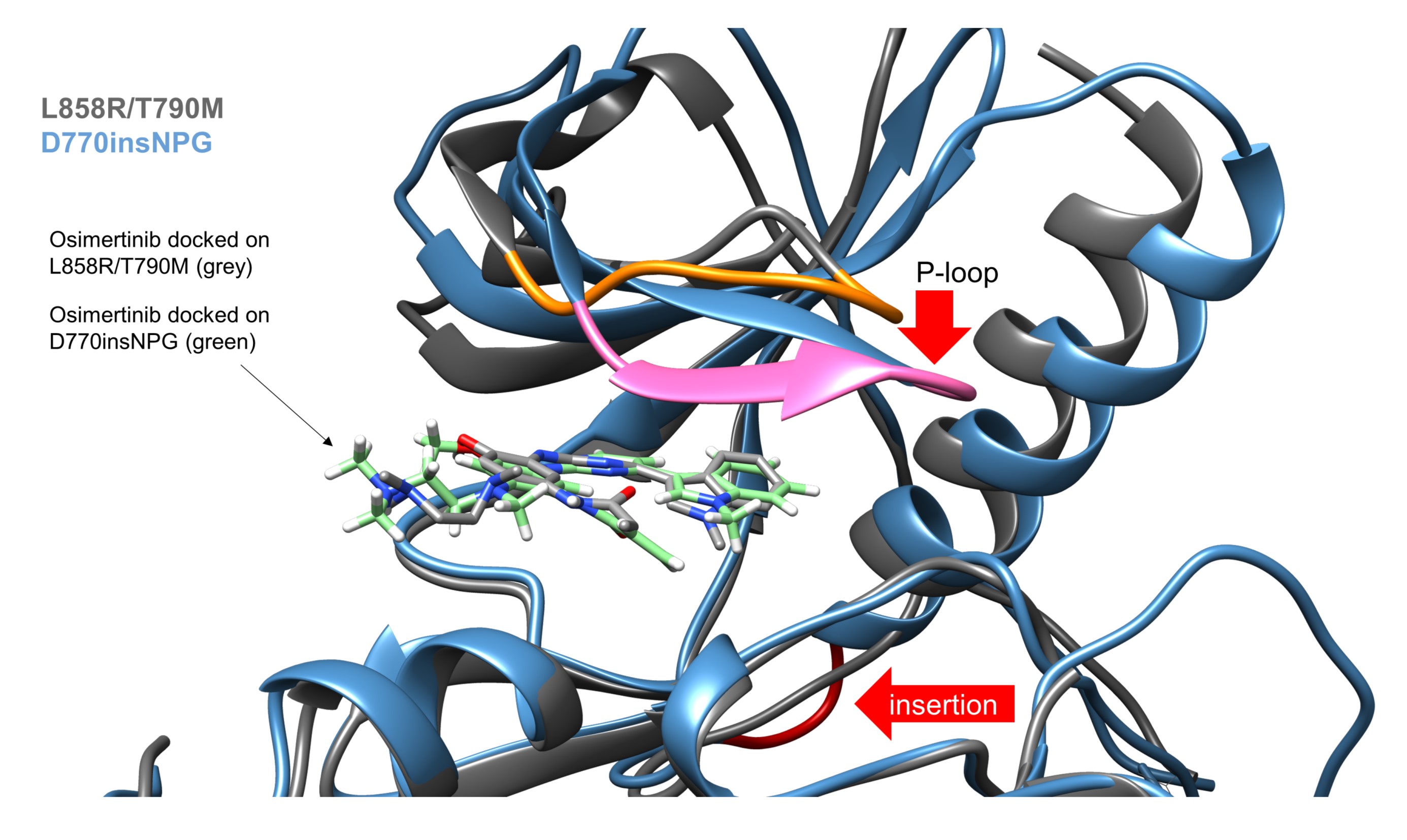
그림 2. EGFR 엑손 20 삽입 돌연변이에 대한 표적치료제 효능 및 결합력 예측 모델
논문링크 : https://www.sciencedirect.com/science/article/pii/S1556086419303697

