[연구동향]
Apolipoprotein B binds to enolase-1 and aggravates inflammation in rheumatoid arthritis
Ann Rheum Dis. 2018 Jul 11.
 송영욱 교수(내과학교실)
송영욱 교수(내과학교실)
아포지단백B (Apolipoprotein B, ApoB)는 정상적인 에너지 대사를 하는 동안 지질의 전달에 필수적인 요소이며, 동맥경화에도 관여한다. 이러한 아포지단백이 면역계에서도 기능을 수행하는 것으로 알려져 있으나 아직까지 염증성 관절염에서의 역할에 대해서는 잘 알려져 있지 않다. 최근 서울대학교병원 류마티스내과 연구팀은 아포지단백B가 면역세포의 세포막에 발현되는 에놀레이즈를 통해 류마티스관절염의 염증반응을 악화시킨다는 것을 규명하였다. 류마티스관절염 환자의 활막액 내에 존재하는 아포지단백B가 면역세포에서의 염증성 사이토카인의 발생을 증가시켰고 (그림 1), 관절염 마우스 모델에서도 아포지단백B를 투여하였을 때 염증성 사이토카인의 증가 및 관절염이 악화되는 것을 확인하였다 (그림 2).
본 연구를 통해 동맥경화와 관련된 아포지단백이 류마티스관절염의 염증반응에도 관여하여 악화시킨다는 것을 새롭게 알게 되었으며, 이러한 사실은 류마티스관절염의 새로운 치료 타겟에 대한 연구에서 응용할 수 있을 것으로 여겨진다.
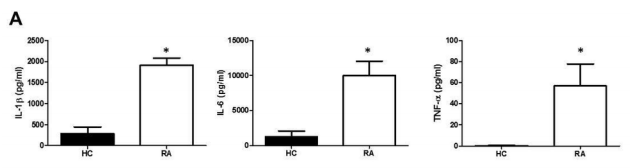 그림 1. ApoB에 의해 자극된 류마티스관절염 환자의 면역세포에서의 사이토카인의 분비 증가
그림 1. ApoB에 의해 자극된 류마티스관절염 환자의 면역세포에서의 사이토카인의 분비 증가
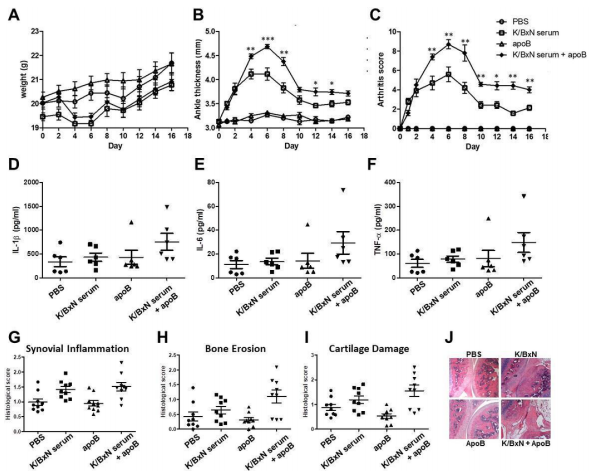 그림 2. K/BxN 관절염 마우스 모델에서 ApoB를 투여하였을 때 관절염 및 조직 소견의 악화
그림 2. K/BxN 관절염 마우스 모델에서 ApoB를 투여하였을 때 관절염 및 조직 소견의 악화
https://ard.bmj.com/content/early/2018/07/11/annrheumdis-2018-213444
PARK7 modulates autophagic proteolysis through binding to the N-terminally arginylated form of the molecular chaperone HSPA5
Autophagy, Published online: 23 Jul 2018
 권용태 교수
권용태 교수
 김대호 학생
김대호 학생
세포 내 자식작용 (Autophagy)은 특이적인 수용체의 작용 여부에 따라 일반적인 자식작용 (General autophagy)과 선택적 자식작용 (Selective autophagy)으로 나눌 수 있다. 그러나 스트레스를 선택적으로 인식하고 반응하는 스트레스 특이적인 수용체와 세포 내 스트레스로 발생된 변성 단백질 (misfolded proteins) 등을 인식하고 분류하는 자세한 기작은 아직 알려져 있지 않다. 한편 과량의 활성 산소체 (Reactive oxygen species, ROS) 가 세포 내에서 생성될 경우, 세포 내 다양한 물질과 반응하여 변성 단백질 (misfolded proteins) 및 기타 세포내 독성물질을 만들게 되고, 이는 세포 내 스트레스 (산화적 스트레스, oxidative stress) 로써 작용하게 된다. 이러한 과량의 활성 산소체를 제거하는 역할을 하는 다양한 세포 내 제거 시스템 (oxidative stress scavengers) 들이 존재하고 있지만 이들 제거 시스템은 단지 과량으로 생성된 활성산소체의 농도를 낮추거나 혹은 다른 기작에서 부산물로 발생한 활성산소체의 양을 조절하는 기능을 하고 있다. 따라서 현재까지 규명된 기작은 과량의 활성산소체가 원인이 되어 생기는 세포 내 독성물질의 처리에 대해 설명할 수 없는 한계를 가지고 있다.
본 연구진에서는 세포 내 자식작용 (autophagy)에 참여하는 소포체 내 샤페론 단백질 (HSPA5/BiP, ER chaperone)과 세포 내 활성산소체 인식 및 제거 기능을 가지고 있는 것으로 알려진 PARK7/DJ-1의 상호작용을 규명함으로써 생성된 변성 단백질 (misfolded proteins)의 처리에 관한 기작을 규명하였다. 이 기작에서는, 과량 발생한 활성 산소체를 PARK7이 인식하고, PARK7 단백질 스스로 산화 됨으로써 단백질의 특성이 변화되고 이와 동시에 ATE1 R-transferase에 의해 N-말단에 arginine (아르기닌)이 부착된 소포체 단백질 HSPA5/BiP과 상호작용하게 된다 (그림 1, 단계 ②, ③). 이때 HSPA5/BiP과 PARK7/DJ-1이 이룬 단백질 결합체 (protein complex) 는 세포내 산화적 스트레스에 의해 변성된 단백질들을 인식하여 본 단백질 결합체에 부착되며 이로써 또 다른 결합체를 형성하게 된다 (그림 1, 단계 ④, ⑤). 이 단백질 결합체는 다시 자식작용 수용체 (autophagic receptor) SQSTM1/p62에 결합하여 자식작용 수용체를 활성화 하게 되고 (그림 1, 단계 ⑥), 이로써 자식작용 (autophagy)이 활성화 되어 변성단백질을 리소좀에 전달되어 분해되게 한다 (그림 1, 단계 ⑦, ⑧). 본 연구에서는 기존에 알려진 활성산소체 인식 및 제거 단백질 PARK7/DJ-1의 소포체 단백질 HSPA5/BiP과의 새로운 상호작용을 확인하였고, 이 상호작용은 산화적 스트레스로 생성된 변성단백질을 인식하여 세포 내 자식작용 (autophagy)으로 전달하게 되며, 이 과정을 통해 세포 내 과량 발생한 변성단백질을 처리하는 과정에 중요한 역할을 하고 있음을 규명하였다.
본 연구는 각종 퇴행성뇌질환의 치료제 개발의 분자생물학적 전략을 제시하면 이에 관한 후속연구를 진행하고 있다.
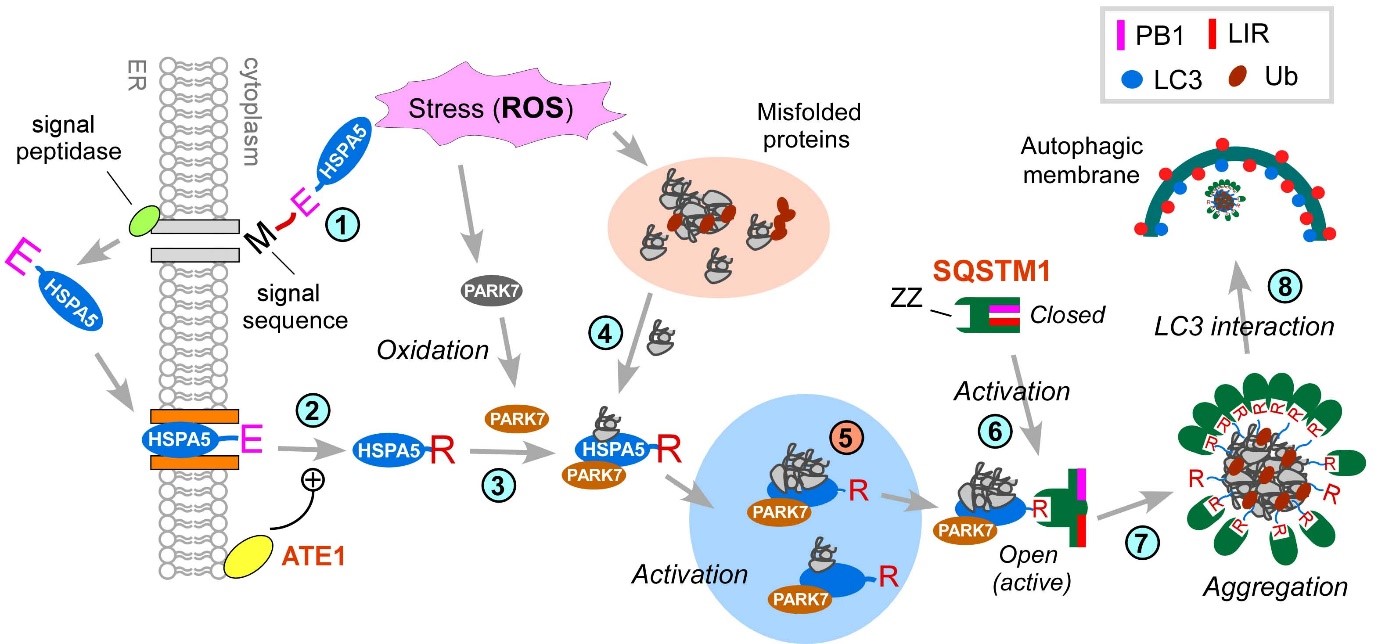 그림 1. 활성산소체에 의해 발생한 변성단백질의 분해를 매개하는 기작을 보여주는 모식도
그림 1. 활성산소체에 의해 발생한 변성단백질의 분해를 매개하는 기작을 보여주는 모식도
https://www.tandfonline.com/doi/abs/10.1080/15548627.2018.1491212